يحتوي الفلافونويد بروسيانيدين C1 على نشاط علاجي ويزيد من عمر الفئران
الملخص
إن التدهور الوظيفي للأعضاء المرتبط بالشيخوخة وزيادة خطر الإصابة بالأمراض المزمنة المرتبطة بالعمر ناتج جزئيًا عن تراكم الخلايا الشائخة ، التي تطور النمط الظاهري الإفرازي المرتبط بالشيخوخة (SASP). نوضح هنا أن procyanidin C1 (PCC1) ، وهو مكون بوليفينول لمستخلص بذور العنب (GSE) ، يزيد من فترة الصحة والعمر الافتراضي للفئران من خلال تأثيره على الخلايا الشائخة. من خلال فحص مكتبة من المنتجات الطبيعية ، نجد أن GSE و PCC1 كأحد مكوناتها النشطة ، لهما تأثيرات محددة على الخلايا الشائخة. عند التركيزات المنخفضة ، يبدو أن PCC1 يثبط تكوين SASP ، بينما يقتل بشكل انتقائي الخلايا الشائخة بتركيزات أعلى ، ربما عن طريق تعزيز إنتاج أنواع الأكسجين التفاعلية والخلل الوظيفي في الميتوكوندريا. في نماذج القوارض ، يستنفد PCC1 الخلايا الشائخة في بيئة مكروية للورم المتضرر من العلاج ويعزز الفعالية العلاجية عند مشاركته مع العلاج الكيميائي. يؤدي الإعطاء المتقطع لـ PCC1 إلى الفئران المشعة والمُغروسة بالخلايا أو المسنة بشكل طبيعي إلى التخفيف من الخلل الوظيفي الجسدي وإطالة فترة البقاء على قيد الحياة. نحدد PCC1 كعامل علاجي طبيعي له نشاط في الجسم الحي وإمكانية عالية لمزيد من التطوير كتدخل سريري لتأخير أو تخفيف أو منع الأمراض المرتبطة بالعمر.
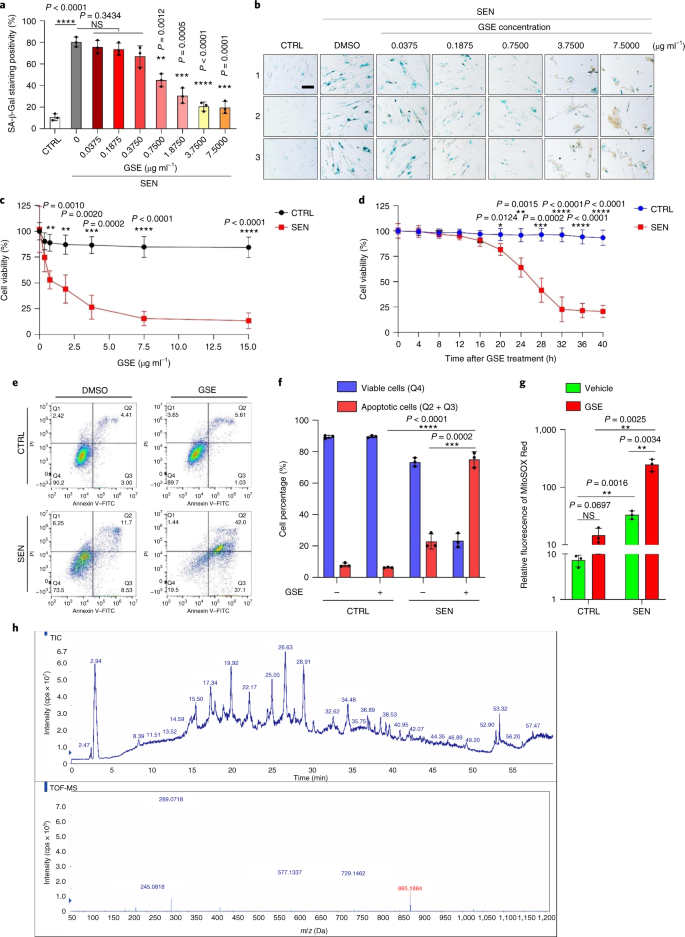
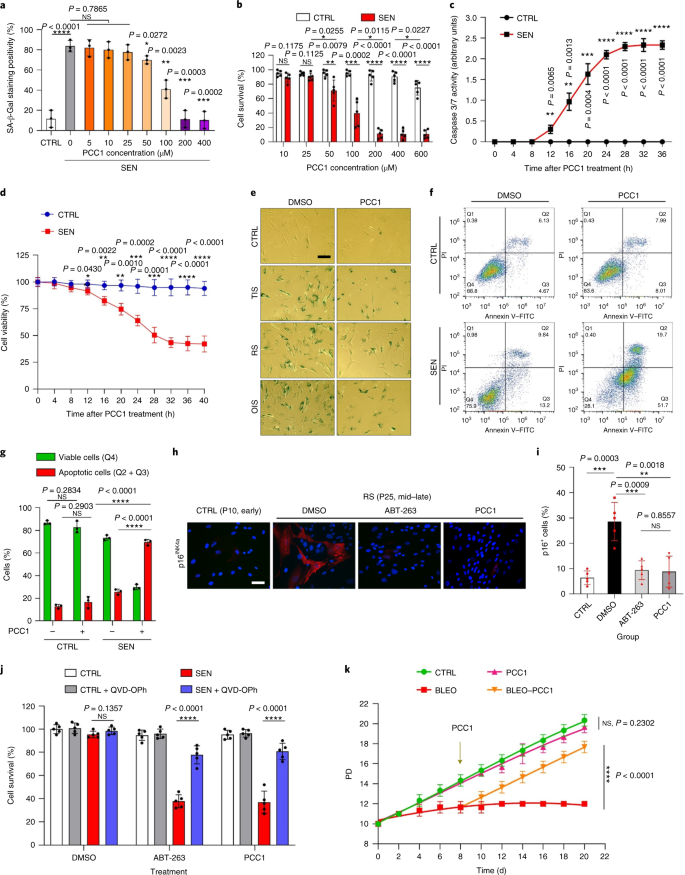
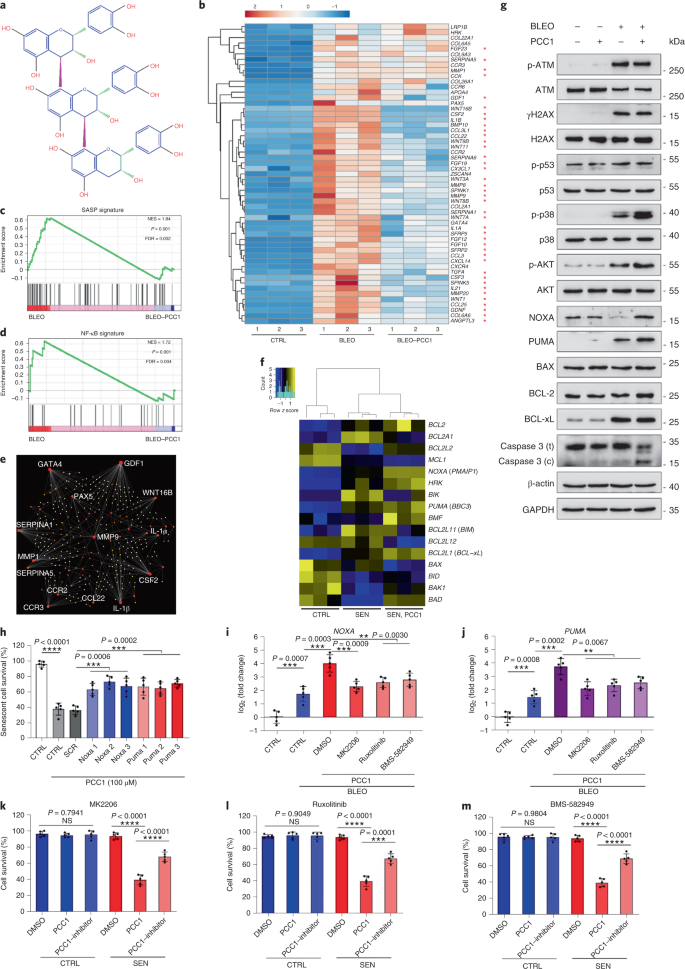
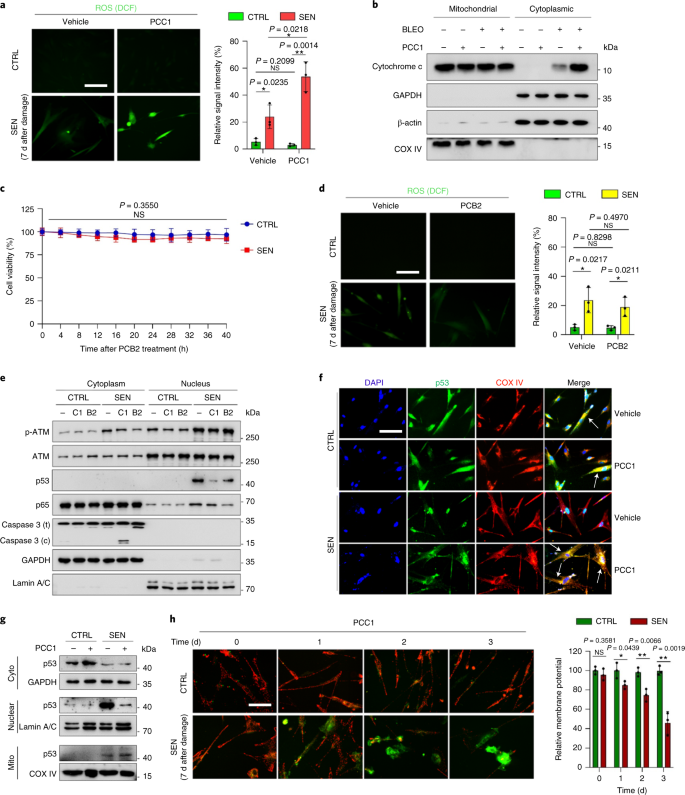
الشيخوخة هي أحد أكبر عوامل الخطر للاضطرابات المزمنة ، بما في ذلك أمراض القلب والأوعية الدموية ، واضطرابات التمثيل الغذائي ، وأمراض التنكس العصبي والأورام الخبيثة المتنوعة ، والتي تمثل معًا الجزء الأكبر من الاعتلال والوفيات والتكاليف الصحية على مستوى العالم1. تم إحراز تقدم كبير خلال السنوات الأخيرة لتطوير عوامل محددة لعلاج الحالات الفردية المرتبطة بالعمر ، مثل مرض السكري من النوع 2 ، وهشاشة العظام ، وهشاشة الهيكل العظمي ، واختلال الأوعية الدموية. ومع ذلك ، فإن التأثير المشترك لهذه الأدوية في السيطرة على المراضة والوفيات من الأمراض المزمنة كان متواضعا ، وتميل هذه الأمراض إلى الحدوث بشكل متزامن مثل الأمراض المتعددة ، مع زيادة انتشارها أضعافا مضاعفة بعد 70 سنة من العمر2. تم تحديد العديد من العوامل الرئيسية التي تؤثر على فترة الصحة والعمر من خلال الدراسات عبر مجموعة من الأنواع وتم تعريفها على أنها آليات الشيخوخة التي يمكن تصنيفها إلى تسع سمات مميزة3. من بين آليات الشيخوخة الأساسية هذه ، حظي الشيخوخة الخلوية باهتمام كبير ، لأنها تمثل عملية قابلة للدواء تمنع أو تؤخر الأمراض المصاحبة للشيخوخة المتعددة4. تم الإبلاغ عن الشيخوخة الخلوية لأول مرة في الستينيات من القرن الماضي ، وهي تشير إلى حالة خلوية تتضمن توقفًا تكراريًا لا رجوع فيه بشكل أساسي ، وتغيرات عميقة في الكروماتين ، ومقاومة موت الخلايا المبرمج وزيادة تخليق البروتين ، والتي غالبًا ما تبلغ ذروتها في الإفراط في إنتاج السيتوكينات المؤيدة للالتهابات ، وهي ميزة تسمى SASP ، والتي يُعتقد أنها دفع الأنماط الظاهرية للشيخوخة والأمراض المختلفة المرتبطة بالعمر5. استئصال الخلايا الشائخة إيجابي لعلامة الشيخوخة ص 16INK4A يخفف من تنكس الأنسجة ويطيل فترة صحة الحيوان ، مما يدعم الادعاء بأن الخلايا الشائخة تلعب دورًا مسببًا في شيخوخة الكائنات الحية6و7. ألهم النجاح في الدراسات قبل السريرية الشروع في تجارب إكلينيكية لإثبات صحة المفهوم تتضمن مضادات للشيخوخة للعديد من الأمراض البشرية مع إمكانية تقليل عبء الخلايا المتشيخة في الجسم الحي من خلال الاستبعاد الدوائي الانتقائي8و9و10. منذ الاكتشاف الأول في عام 2015 (المرجع. 11) ، تُعرف الآن حفنة من عوامل الحالة للشيخوخة الاصطناعية أو الجزيئية الصغيرة. تعتمد استراتيجيات الاستهداف بشكل أساسي على آلية مقاومة الخلايا الشائخة للاستماتة ، والتي يبدو أنها تعتمد على المسارات المضادة للاستماتة المرتبطة بالشيخوخة والتي تسمح ببقاء الخلايا الشائخة لفترات طويلة12و13. تحمل الإدارة المتقطعة لمضادات الشيخوخة القدرة على تقليل مخاطر إصابة المرضى بظروف معاكسة ، وتقليل الآثار غير المستهدفة للأدوية ، ومنع تطور مقاومة الأدوية للخلايا الشائخة ، التي لا تنقسم ، وهي خاصية تميزها عن الخلايا السرطانية ، مثل تكتسب الخلايا السرطانية في كثير من الأحيان طفرات مفيدة توفر مقاومة ضد العلاجات المضادة للسرطان. ومع ذلك ، فإن معظم الأدوية الحالة للشيخوخة التي تم الإبلاغ عنها تعتمد على سلالة الخلية أو نوع الخلية أو ، بدلاً من ذلك ، تُظهر سمية خلوية كبيرة في الجسم الحي ، مما يحد من استخدامها المحتمل للأغراض السريرية. في هذه الدراسة ، قمنا بفحص مكتبة طبية للمنتجات الطبيعية تتكون من عوامل مضادة للشيخوخة وحددنا العديد من المرشحين بما في ذلك GSE. كشف تحليل إضافي أن PCC1 ، أحد مكونات إبيكاتشين من النوع B من فلافونويد GSE ، يلعب دورًا رئيسيًا في تثبيط تعبير SASP بتركيزات منخفضة وقتل الخلايا المتشيخة بتركيزات أعلى ، وهذا الأخير من خلال إحداث موت الخلايا المبرمج. اقترحت البيانات قبل السريرية أنه ، بالاقتران مع العلاج الكيميائي الكلاسيكي ، يمكن أن يقلل PCC1 بشكل كبير من حجم الورم ويطيل البقاء على قيد الحياة في العديد من نماذج الفئران. وبالتالي ، فإن PCC1 يمثل فئة جديدة من المواد الكيميائية النباتية المعزولة من المصادر الطبيعية التي تؤخر الشيخوخة وتقلل من الاضطرابات المرتبطة بالعمر وتضمن المزيد من الاستكشاف كعامل محتمل للشيخوخة في الطب السريري. في محاولة لتحديد المركبات الجديدة التي يمكنها تعديل الخلايا المتشيخة بشكل فعال ، تم إجراء فحص غير متحيز للعامل باستخدام مكتبة كيميائية نباتية تتكون من 46 من العوامل الطبية المشتقة من النباتات (مكتبة PDMA). استخدمنا خط خلايا انسداد البروستاتا البشري الطبيعي الأساسي ، PSC ، كنموذج قائم على الخلايا لهذا الغرض. يتكون بشكل أساسي من الخلايا الليفية ولكن مع نسبة ضئيلة من سلالات الخلايا غير الليفية بما في ذلك الخلايا البطانية وخلايا العضلات الملساء ، يعتبر PSC27 خطًا خلويًا أوليًا بحد ذاته ويطور SASP نموذجي بعد التعرض للضغوط مثل العلاج الكيميائي السام للجينات أو الإشعاع المؤين14و15و16و17. عالجنا هذه الخلايا بجرعة مميتة مُحسَّنة مسبقًا من البليوميسين (50 ميكروغرام مل−1) ولاحظوا زيادة تلطيخ β-galactosidase المرتبط بالشيخوخة (SA-β-Gal) ، وانخفاض دمج 5-bromodeoxyuridine وزيادة بؤر إصلاح تلف الحمض النووي (DDR) بعد 7-10 أيام (الشكل التكميلي S1). 1 أ - ج). لقد وضعنا استراتيجية فحص لمقارنة التأثيرات التي تركتها المنتجات الطبية الفردية على ملف البقاء على قيد الحياة والتعبير للخلايا الشائخة (Extended Data Fig. 1 أ). تتمثل إحدى الميزات الواعدة للعوامل الحالة للشيخوخة في التحفيز الانتقائي للموت المبرمج للخلايا الشائخة ، مثل ABT-263 و ABT-737 والاستخدام المشترك لـ dasatinib و quercetin11و18و19. اختبرنا أولاً فاعلية هذه الأدوية المضادة للشيخوخة ضد خلايا PSC27 الشائخة لإثبات إمكاناتها كنموذج خلية تجريبي لفحص الأدوية. تشير بياناتنا الأولية إلى أن كل من هذه المركبات قد استنفد الخلايا المتشيخة بشكل كبير ولكن لا تنتشر الخلايا ، مما يؤكد جدوى استخدام هذا الخط اللحمي لمزيد من الدراسات (Extended Data Fig. 1 ب). عند فحص مكتبة PDMA على نطاق واسع ، حددنا العديد من المركبات التي لديها القدرة على قتل الخلايا الشائخة بشكل انتقائي في الثقافة (Extended Data Fig. 1c-e). من بين العوامل التي أظهرت تأثيرات أولية مضادة للشيخوخة كانت GSE و quercetin و fisetin و curcumin و piperlongumine (Extended Data Fig. 1 د ، ه). يتشارك الكيرسيتين والفيستين في تراكيب كيميائية متشابهة ، ويمارسان تأثيرات طبية متشابهة وكلاهما من الأدوية الحالة للشيخوخة.11و20و21. يعتبر الكركمين والبيبرلونجومين أيضًا من المركبات الطبيعية التي لها إمكانات حال للشيخوخة تم اكتشافها مؤخرًا22و23. اخترنا التركيز على GSE ، التي ظلت مصدرًا غير مكتشفة إلى حد كبير. في ظروف المختبر ، قمع GSE SASP بكفاءة قصوى عند 0.1875 ميكروغرام مل−1 (البيانات الموسعة الشكل. 2a) ، والتي تتناسب مع خاصية السينومورفكس24. كانت التركيزات المنخفضة أو الأعلى من GSE أقل فعالية ، ربما بسبب تحريض استجابات الإجهاد الخلوي نتيجة لزيادة السمية الخلوية (Extended Data Figure. 2a). باستخدام RNA-seq ، وجدنا أن العلاج باستخدام GSE غيّر بشكل كبير المظهر الجانبي للتعبير عن خلايا الشيخوخة ، مع 2644 جينًا خاضعًا للتنظيم و 1472 جينًا مُنظمًا بتغير أضعاف قدره 2.0 لكل جين (ص <0.01) (البيانات الموسعة الشكل. 2b). على الرغم من أن التعبير عن عدد قليل من الجينات غير المرتبطة بـ SASP أظهر اتجاهًا مشابهًا لاتجاه عوامل SASP النموذجية (Extended Data Fig. 2c) ، دعمت البيانات المأخوذة من تحليل تخصيب مجموعة الجينات (GSEA) التعبير المنخفض عن التوقيعات الجزيئية لمركب SASP أو تنشيط العامل النووي (NF) -B المركب ، وهو وسيط رئيسي للنمط الظاهري المؤيد للالتهابات (البيانات الموسعة الشكل. 2 د ، ه). تمت ملاحظة النقل النووي لـ p65 ، إحدى الوحدات الفرعية الرئيسية لمركب NF-B ، في الخلايا الشائخة ، بما يتوافق مع مشاركتها الوظيفية في تعبير SASP14 (البيانات الموسعة الشكل. 2f). من الجدير بالملاحظة أن هذا الاتجاه كان معاديًا بشكل كبير بواسطة GSE بتركيزات منخفضة (مثل 0.1875 ميكروغرام مل.−1). على العكس من ذلك ، لم يتم قمع تنشيط إشارات NF- B ولكن تم تحسينه بدلاً من ذلك عند استخدام GSE بتركيزات أعلى (مثل 3.7500 ميكروغرام مل−1) ، مما يشير إلى الاستجابات التفاضلية للخلايا الشائخة في ظروف العلاج هذه. كان تنشيط إشارات DDR ، كما يتضح من فسفرة كيناز ATM في الكسور النووية ، والتعبير عن رابط Chemokine chemokine (CXCL) 8 ، أحد العوامل المميزة لـ SASP ، كما لوحظ في الكسور السيتوبلازمية ، متسقًا مع NF -تفعيل B في هذه الإعدادات (Extended Data Fig. 2f). كشف توصيف التفاعل بين البروتين والبروتين عن شبكة نشطة للغاية تتضمن عوامل متعددة يتم تنظيمها بشكل كبير عند الشيخوخة الخلوية ولكن يتم تنظيمها بمجرد تعرض الخلايا لـ GSE (البيانات الموسعة الشكل. 3 أ). كشف التنميط الأنطولوجي الجيني أن هذه الجزيئات تعمل وظيفيًا في العمليات البيولوجية وترتبط بالمكونات الخلوية المتوافقة عمومًا مع الطبيعة المفرزة لـ SASP (البيانات الموسعة الشكل. 3 ب ، ج). وبالتالي ، فإن GSE هو منتج طبيعي لديه القدرة على التحكم في المظهر الجانبي المؤيد للالتهابات للخلايا الشائخة ، SASP ، عند استخدامه ضمن نطاق تركيز معين. على الرغم من أن GSE لم يكن المنتج الطبيعي الوحيد الذي يتمتع بفعالية حال للشيخوخة في فحوصاتنا المستندة إلى الخلايا (Extended Data Fig. 1 د ، ه) ، ركزت دراستنا اللاحقة إلى حد كبير على GSE ، حيث بدت قدرتها على الحماية من الشيخوخة مذهلة بشكل خاص. نظرًا لفعالية GSE في تقليل SASP كعامل مشوه ، قمنا بعد ذلك باستجواب إمكانات هذا المنتج الطبيعي في قتل الخلايا المتشيخة بتركيزات أعلى من خلال العمل كمزيل للشيخوخة. أشار تلوين SA-β-Gal إلى أنه تم التخلص من الخلايا المتشيخة بتركيز GSE من 0.75 ميكروغرام مل−1 (تين. 1 أ ، ب). عند 3.75 ميكروجرام مل−1 GSE ، تم الوصول إلى هضبة من 20 ٪ من بقاء الخلايا الشائخة (الشكل. 1 أ ، ب). أ، القياس الكمي لبقاء خلية PSC27 الشائخة بإيجابية SA-β-Gal. تم تطبيق GSE على الوسط بتركيزات متزايدة. CTRL ، خلايا التحكم (المتكاثرة) ؛ SEN ، الخلايا الشائخة NS ، ليس كبيرا. ص تم حساب القيم عن طريق ANOVA أحادي الاتجاه مع اختبار Tukey للمقارنة المتعددة. ب، صور تمثيلية تعرض تلطيخ SA-β-Gal بعد علاج خلايا PSC27 بتركيزات مختلفة من GSE. شريط النطاق ، 20 ميكرومتر. البيانات هي ممثل لثلاث تجارب مستقلة. DMSO ، ثنائي ميثيل سلفوكسيد. ج، تحليل البقاء على قيد الحياة لخلايا PSC27 الضابطة والشيخوخة عند العلاج باستخدام GSE (بتركيزات 0.3750 و 0.7500 و 1.8750 و 3.7500 و 7.5000 و 15.0000 ميكروغرام مل)−1، على التوالى). يتم عرض البيانات على أنها متوسط ± sd وتم اشتقاقها من ثلاث مكررات بيولوجية (ن = 3 فحوصات مستقلة). ص تم حساب القيم على الوجهين ر- الاختبارات. د، قياس الدورة الزمنية للجدوى في المختبر عند علاج خلايا PSC27 الضابطة والشيخوخة باستخدام GSE (3.75 ميكروغرام مل)−1). يتم عرض البيانات على أنها متوسط ± sd وتم اشتقاقها من ثلاث مكررات بيولوجية (ن = 3 تجارب مستقلة). ص تم حساب القيم على الوجهين ر- الاختبارات. و، قياس التدفق الخلوي لخلايا التحكم والخلايا المتشخخة PSC27 بعد المعالجة باستخدام مجموعة الملحق V-FITC و propidium iodide (PI) وتلطيخ 4،6-Diamidino-2-phenylindole (DAPI) لتحديد مدى موت الخلايا المبرمج. الربع الأول - الربع الرابع ، الشرائح الربعية 1-4. F، القياس الكمي المقارن للنسبة المئوية القابلة للحياة (Q4، PI-الملحق الخامس-) والاستماتة (Q2 و Q3 ، PI+الملحق الخامس+ و PI-الملحق الخامس+، على التوالي) الخلايا الموجودة في المجموعة الضابطة أو المسننة المعالجة بالمركبة أو GSE لمدة 3 أيام (ن = 3 فحوصات مستقلة بيولوجيا). ص تم حساب القيم على الوجهين ر- الاختبارات. ز، قياس إشارة التألق لـ MitoSOX Red ، وهو مؤشر فوق أكسيد الميتوكوندريا ، في خلايا PSC27 تحت ظروف مختلفة. ص تم حساب القيم على الوجهين ر- الاختبارات. ح، أطياف الكتلة عالية الدقة التي توضح مخطط كروماتوجرام الأيونات الكلي (TIC) والرسم اللوني الذروة الأساسي لـ GSE بعد إجراء HPLC-ESI-QTOF-MS. ما لم يُذكر خلاف ذلك ، خضعت الخلايا للتحليلات ذات الصلة بعد 3 أيام من علاج GSE في حالة الثقافة. cps ، تعد في الثانية. تظهر البيانات في الرسوم البيانية الشريطية ومنحنيات الانحدار على أنها متوسط ± sd وتمثل ثلاث مكررات بيولوجية. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01 ؛ ***ص <0.001 ؛ ****ص <0.0001. أظهرت فحوصات بقاء الخلية أن GSE يسبب موت الخلايا الشائخة ولكن لا ينتشر موت الخلايا بدءًا من تركيز 0.75 ميكروغرام مل.−1 (تين. 1 ج). بتركيز 7.50 ميكروجرام−1، انخفضت النسبة المئوية للخلايا المتشيخة الباقية إلى حوالي 10٪ ، بينما لم تتأثر صلاحية الخلايا المتكاثرة حتى عند 15.00 ميكروغرام مل.−1 GSE (الشكل. 1 ج) ، وهو أعلى تركيز مستخدم في فحوصاتنا الخلوية ، مما يشير إلى انتقائية وخصوصية بارزة لـ GSE ضد الخلايا الشائخة ، والتي تعد من السمات الرئيسية لحالات الشيخوخة. قمنا بعد ذلك بقياس قدرة GSE على استهداف الخلايا المتشيخة بشكل مختلف في دورة زمنية. عند العلاج بـ GSE بتركيز 3.75 ميكروجرام مل−1، لم تنخفض قابلية بقاء الخلايا الشائخة بشكل ملحوظ إلا بعد 20 ساعة. وصل الاختلاف في الجدوى بين الخلايا الشائخة والسيطرة (الخلايا المتكاثرة) إلى الحد الأقصى بعد 32 ساعة ، مما يعني عدم تجانس المقاومة الجوهرية لمحللات الشيخوخة في مجموعات الخلايا الشائخة (الشكل 1 ب). 1 د). نظرًا لأن خلاصة بذور الجريب فروت تولد تأثيرات مميزة ضد الخلايا الشائخة ، فقد قمنا بتحليل فعالية خلاصة بذور الجريب فروت في إحداث موت الخلايا المبرمج. أظهر قياس التدفق الخلوي انخفاضًا كبيرًا في قابلية البقاء ، في حين تم رفع موت الخلايا المبرمج للخلايا المتشيخة ولكن ليس الخلايا المتكاثرة (الشكل 1 أ). 1 هـ ، ص والشكل التكميلي. 2a). يعد الخلل الوظيفي في الميتوكوندريا والتغيرات الأيضية من السمات المميزة للخلايا الشائخة والشيخوخة العضوية ، وهي أحداث تسبب الإجهاد التأكسدي وإنتاج أنواع الأكسجين التفاعلية (ROS) مثل الأكسيد الفائق3و25. استخدمنا MitoSOX Red ، وهو مؤشر فوق أكسيد الميتوكوندريا26، لاستكشاف التغيرات بين الخلايا ووجد أن GSE عززت توليد ROS للميتوكوندريا في الخلايا الشائخة ولكن ليس في الخلايا المتكاثرة (الشكل. 1 جرام). وبالتالي ، تتوافق بياناتنا مع نموذج تقتل فيه خلاصة بذور الجريب فروت الخلايا الشائخة من خلال تحريض موت الخلايا المبرمج وتفاقم إجهاد الميتوكوندريا في المختبر. تبلغ نسبة بذور العنب 38-52٪ ، على أساس المادة الجافة ، من العنب وتشكل مصدرًا غزيرًا لمضادات الأكسدة27. قمنا بتطبيق كروماتوغرافيا سائلة عالية الضغط (HPLC) مقترنة بمقياس الطيف الكتلي الرباعي لوقت الرحلة (QTOF-MS) المجهز بواجهة تأين بالرش الكهربائي (ESI) لتحديد المكونات الرئيسية لـ GSE. وجدنا ثلاث فئات رئيسية من المواد الكيميائية النباتية ، بما في ذلك الأحماض الفينولية والفلافونويد (مثل فلافان 3-أول ، بروسيانيدينز) ومركبات أخرى (الشكل 1 ب). 1 ساعة والجدول التكميلي 1). من بينها ، تم تحديد عدد قليل من المكونات على أنها البروسيانيدين ومشتقاتها ، والتي تم الإبلاغ عنها لاستهداف بروتينات الميتوكوندريا والتخفيف من الأمراض المزمنة المتعددة28. ومع ذلك ، فإن المكون (المكونات) الرئيسية التي تتوسط في وظيفة الحالة للشيخوخة في GSE لا تزال غير واضحة إلى حد كبير. تشمل الأنشطة البيولوجية المبلغ عنها لبروسيانيدينات بذور العنب الحد من الضرر التأكسدي ، وقمع الالتهاب وتحريض موت الخلايا المبرمج للخلايا السرطانية29و30و31و32. من بين المركبات الفردية الموجودة في GSE ، يتطلب PCC1 اهتمامًا خاصًا ، حيث ثبت أنه يتسبب في تلف الحمض النووي ، ويسبب توقف دورة الخلية ويزيد من التعبير عن كينازات نقاط التفتيش33. تشير البيانات المأخوذة من التحليل الأولي (إجمالي كروماتوجرام أيون) لـ GSE ، وهو مزيج من العوامل الكيميائية النباتية في حد ذاته ، بواسطة HPLC-QTOF-MS إلى وجود PCC1 ، كملف تعريف GSE عند قمم MS محددة يتوافق مع ملف تعريف كروماتوجرام PCC النقي كيميائيًا 1 تم الحصول عليها من مصدر تجاري (الشكل. 1 ساعة والشكل التكميلي. 2b). ثبت أن PCC1 يقلل من مستوى BCL-2 ولكنه يزيد من التعبير عن المنظم BAX وأنشطة الكاسبيز 3 و 9 في الخلايا السرطانية المستزرعة ، وبالتالي يحتمل أن يولد تأثيرات مضادة للسرطان من خلال تحريض موت الخلايا المبرمج33. ومن ثم ، قمنا بعد ذلك بتقييم قدرة وانتقائية PCC1 للقضاء على الخلايا الشائخة في الثقافة. تشير البيانات إلى أن PCC1 هو حالة للشيخوخة للخلايا اللحمية الشائخة التي تبدأ بتركيز 50 ميكرومتر ، حيث تظل الخلايا المتكاثرة غير متأثرة إلى حد كبير (الشكل 1 أ). 2 أ ، ب والجدول التكميلي 2). على الرغم من أن التركيزات الأعلى تسببت في انخفاض معدل البقاء على قيد الحياة للخلايا الشائخة ، مع عتبة تقارب 200 ميكرومتر ، أظهر PCC1 سمية فقط تجاه خلايا التحكم عند استخدامه عند 600 ميكرومتر أو أعلى (الشكل. 2b). أشار مسار زمني لنشاط caspase 3/7 إلى أن PCC1 مارس تأثيرات موت الخلايا المبرمج في غضون 12 ساعة ، ووصل إلى هضبة عند 24 ساعة (الشكل 5 ب). 2c). كانت هذه النتيجة متوافقة إلى حد كبير مع قياسات الجدوى (الشكل. 2 د). تم تأكيد الطبيعة الحالة للشيخوخة لـ PCC1 من خلال الخلايا التي دخلت الشيخوخة بسبب الإرهاق المتماثل أو الشيخوخة (RS) أو الجين الورمي (HRAS)G12V) الإفراط في التعبير (OIS) ، والذي يولد إهانات مرهقة مماثلة لتلك التي يسببها العلاج للشيخوخة (الشكل. 2e، البيانات الموسعة الشكل. 4 ب - هـ والجدول التكميلي 2). تشير النتائج معًا إلى أن PCC1 يزيل بشكل انتقائي الخلايا اللحمية البشرية التي تسببها محفزات مختلفة بطريقة تعتمد على الجرعة ولكن دون تأثير كبير على الخلايا غير المتوهمة عند استخدامه بتركيزات مناسبة. أ، قياس بقاء الخلية الشائخة PSC27 بواسطة تلطيخ SA-β-Gal. تم تطبيق PCC1 بتركيزات متزايدة. ص تم حساب القيم عن طريق ANOVA أحادي الاتجاه مع اختبار Tukey للمقارنة المتعددة. ب، بقاء الخلايا الشائخة PSC27 التي يسببها البليوميسين عند زيادة تركيزات PCC1. ج، مقايسة أبوبتوتيك لنشاط كاسباس 3/7. د، منحنيات بقاء الدورة الزمنية لتقييم قابلية بقاء الخلية PSC27 بعد علاج PCC1. و، صور تلطيخ SA-β-Gal. TIS ، الشيخوخة التي يسببها العلاج (عن طريق بليوميسين). شريط النطاق ، 20 ميكرومتر. البيانات هي ممثل لثلاث تجارب مستقلة. F، قياس التدفق الخلوي بعد المعالجة باستخدام مجموعة ملحقة V-FITC و PI وتلطيخ DAPI لتحديد مستويات موت الخلايا المبرمج. ز، تحديد النسبة المئوية للبقاء (Q4 ، PI-الملحق الخامس-) والاستماتة (Q2 و Q3 ، PI+الملحق الخامس+ و PI-الملحق الخامس+، على التوالي) الخلايا بعد العلاج بالمركبة أو PCC1 لمدة 3 د (ن = 3 فحوصات مستقلة بيولوجيا). ح، تلطيخ المناعي لخلايا PSC27. تم تحفيز RS بالمرور التسلسلي قبل علاج PCC1. أحمر ، ص 16INK4a. تم استخدام الخلايا في ممر مبكر (P10) كعنصر تحكم سلبي. تم اختبار ABT-263 (1.25 ميكرومتر) كعنصر تحكم إيجابي. شريط النطاق ، 20 ميكرومتر. أنا، إحصائيات تلطيخ المناعي. ي، نشاط تحلل الشيخوخة الناجم عن PCC1 بعد تثبيط عموم كاسباس (20 ميكرومتر QVD-OPh). ل، فحص PD من MSCs البشرية. تم تطبيق PCC1 في اليوم الثامن بعد بداية التجارب كما هو محدد. BLEO ، بليوميسين. ل جودول، يتم عرض البيانات على أنها متوسط ± sd وتم اشتقاقها من ثلاث مكررات بيولوجية (ن = 3 فحوصات مستقلة). للحصول على البيانات بتنسيق ب-دوزوأناويو ص تم حساب القيم على الوجهين ر- الاختبارات. في تجارب ج-ل، تم استخدام PCC1 عند 100 ميكرومتر. ما لم يذكر خلاف ذلك ، تم جمع العينات للتحليل 3 أيام بعد معالجة PCC1. تظهر البيانات في الرسوم البيانية الشريطية على أنها متوسط ± sd وتمثل ثلاث مكررات بيولوجية. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01 ؛ ***ص <0.001 ؛ ****ص <0.0001. لتوسيع وإثبات فعالية PCC1 تجريبياً عبر سلالات الخلايا ، عالجنا الخلايا الليفية في الرئة الجنينية البشرية (WI38) ، والخلايا البطانية الوريدية البشرية الأولية (HUVECs) والخلايا الجذعية الوسيطة البشرية (MSCs) مع PCC1 ووجدنا أن الخلايا الشائخة من جميع هذه السلالات معروضة قابلية مماثلة للاجتثاث الانتقائي بواسطة PCC1 ، في حين أن نظرائهم غير الهامين ظلوا قابلين للحياة (Extended Data Figure. 4f – h والجدول التكميلي 3). أكدنا أيضًا تحريض موت الخلايا المبرمج في الخلايا المتشيخة استجابةً لـ PCC1 عن طريق قياس التدفق الخلوي ، في حين ظلت الخلايا المتكاثرة غير متأثرة إلى حد كبير بـ PCC1 (الشكل 1 ب). 2f,g). باختصار ، تُظهر بياناتنا أن PCC1 يقضي بشكل انتقائي على الخلايا المتشيخة عبر أنواع الخلايا المختلفة والناشئة عن مسببات مختلفة للشيخوخة. لتصور نضوب الخلايا الشائخة بواسطة PCC1 ، قمنا بفحص تعبير p16INK4a، علامة شيخوخة مستخدمة على نطاق واسع ، في الخلايا اللحمية التي عانت من RS. قام PCC1 بإزالة الخلايا المتشيخة إيجابية p16 بشكل فعال ، والتي ظهرت فقط في مجموعات PSC27 المتأخرة ، مع فعالية تشبه إلى حد كبير فعالية ABT-263 (1.25 ميكرومتر) ، وهو عامل مضاد للشيخوخة اصطناعي راسخ18و21 (تين. 2 ح ، أنا). لإثبات أن القضاء على الخلايا المتشيخة بوساطة PCC1 يحدث بشكل رئيسي من خلال تحريض موت الخلايا المبرمج ، بدلاً من الأشكال الأخرى لموت الخلايا المبرمج ، قمنا بمعالجة الخلايا بمثبط موت الخلايا المبرمج pan-caspase quinolyl-valyl-ال- ميثيل الأسبارتيل - (- 2،6 - ديفلوروفينوكسي) - ميثيل كيتون (QVD-OPh). تم عكس قدرة PCC1 على قتل الخلايا الشائخة بواسطة QVD-OPh. وبالتالي ، فإن PCC1 يشترك في تحريض موت الخلايا المبرمج المعتمد على كاسباس كميزة حال للشيخوخة مع ABT-263 (الشكل. 2j). استبعد التحليل الإضافي باستخدام المثبطات الكيميائية موت الخلايا الناجم عن PCC1 من خلال التهاب الخلايا الحديدي أو التهاب الحموضة أو التنخر (البيانات الموسعة الشكل. 4 ط). لتقييم إمكانية مضاعفة عدد الخلايا (PD) بعد العلاج بالأدوية السامة للجينات ، استخدمنا الخلايا الجذعية السرطانية ، التي يمكنها التجديد الذاتي واستئناف الانتشار المستند إلى المستعمرات حتى بعد التعرض للضغوط البيئية34، على الأرجح بسبب عدم تجانس الضرر ، مع تعرض الخلايا لضرر أقل يُفترض أنها قادرة على الاحتفاظ بإمكانية التعافي الذاتي والعودة إلى دورة الخلية24و35. على عكس الخلايا المتضررة من البليوميسين ، والتي دخلت بسرعة في توقف النمو بعد العلاج ، فإن العلاج بعد الشيخوخة باستخدام PCC1 عزز بشكل كبير من قدرة PD في الخلايا الجذعية السرطانية ، خاصة بعد إزالة الخلايا الشائخة التي تطور SASP وتحمل القدرة على إحداث شيخوخة paracrine داخل مجموعات الخلايا (الشكل . 2k). ومع ذلك ، فإن العلاج بـ PCC1 لم يؤثر على PD للخلايا المتكاثرة ، مما يدل على انتقائية PCC1 للخلايا الشائخة مقارنة بنظيراتها الطبيعية. نظرًا لأن GSE عبارة عن خليط كيميائي نباتي معقد ، حيث أبلغت العديد من مكوناته عن أنشطة مضادة للأكسدة ومضادة للالتهابات27و36، قمنا بالتحقيق فيما إذا كان PCC1 هو المكون الرئيسي لـ GSE المتورط في استنفاد الخلايا الشائخة أو ما إذا كانت المواد الكيميائية النباتية البديلة في GSE يمكن أن تسهم في تأثيره الكلي للشيخوخة. تحقيقًا لهذه الغاية ، قمنا بفحص تأثير الجزيئات الكيميائية النباتية الفردية على بقاء خلايا PSC27 الشائخة. فشلت معظم مكونات GSE في إظهار نشاط حال للشيخوخة في نطاق جرعة PCC1 ولم تتسبب في موت كبير للخلايا المتكاثرة (التين التكميلي). 3 و 4). على الرغم من أن مادة الكيرسيتين الفلافونويدية أظهرت نشاطًا مضادًا للشيخوخة كما في دراساتنا السابقة ، إلا أنها خاصية مشتركة مع مركبات الفلافون الطبيعية11و21، "GSE المعاد تكوينه" ، ويتكون من المكونات الرئيسية المختلطة وفقًا لنسبة كتلتها كما كشفت عنها بيانات HPLC-QTOF-MS الخاصة بنا (الجدول التكميلي 1) 1، لاحظ أن كيرسيتين تمثل 0.9 ٪ فقط) ولكن باستثناء PCC1 عن قصد ، لم تظهر نتائج مماثلة لتلك التي لوحظت لـ PCC1 في كلا الاختبارين (الأشكال التكميلية. 3 و 4). على الرغم من أننا لا نستطيع استنتاج ما إذا كانت المكونات الأخرى لها مساهمة ، فإن بياناتنا تشير بوضوح إلى أن PCC1 هو الوسيط الأساسي لتأثير الحالة للشيخوخة لـ GSE. نظرًا للفعالية البارزة لـ PCC1 في التسبب بشكل انتقائي في موت الخلايا الشائخة ، فقد استجوبنا الآلية (الآليات) الأساسية. ينتمي PCC1 إلى عائلة مركبات الفلافونويد الفائقة ، والتي يمكنها التخلص من الجذور الحرة والمعادن المخلَّبة وتقليل تكوين هيدروبيروكسيد ، وخصائص مضادات الأكسدة التي تُعزى إلى مجموعة "-OH" الوظيفية في الهيكل وموقعها على حلقة جزيء الفلافونويد27. تخضع قدرة البروسيانيدين المضادة للأكسدة ، جزئيًا ، إلى درجة البلمرة ، في حين أن PCC1 عبارة عن مادة بروسيانيدين إيبيكاتشين تريدين بطبيعتها (الشكل. 3 أ). أ، التركيب الكيميائي لمادة epicatechin PCC1. ب، خريطة الحرارة التي تصور الجينات العليا (50) تم تنظيمها بشكل كبير في خلايا PSC27 المتخلفة ولكن تم تقليل تنظيمها عند علاج PCC1 (50 ميكرومتر). النجوم الحمراء ، عوامل SASP. ج، مؤامرة GSEA لجين مهم تم تعيينه في طيف SASP. FDR ، معدل الاكتشاف الخاطئ ؛ NES ، درجة تخصيب طبيعية. د، مؤامرة GSEA لمجموعة جينات مهمة مرتبطة بإشارات NF- κB. وخريطة محلل الشبكة لتفاعلات البروتين والبروتين لعوامل نموذجية مرتبطة بـ SASP تم تنظيمها بشكل كبير في الخلايا الشائخة ولكن تم تنظيمها بواسطة علاج PCC1. F، خريطة الحرارة توضح التعبير التفاضلي لجينات عائلة BCL-2 في الخلايا الشائخة والمعالجة بـ PCC1. ز، تعرضت الطعمة المناعية لخلايا PSC27 لعوامل مختلفة. تم فحص التعبير عن العوامل المؤيدة للاستماتة والمضادة للاستماتة والجزيئات المرتبطة بإشارات DDR. Caspase 3 (t) ، إجمالي كاسباس 3 ؛ كاسباس 3 (ج) ، كاسباس مشقوق 3 ؛ ع ، فسفرة. β-actin و GAPDH ، ضوابط التحميل. البيانات هي ممثل لثلاث تجارب مستقلة. ح، أصيبت الخلايا بثلاثة أنواع مختلفة من الحمض النووي الريبي قصير الشعر إصابة أو بوما قبل التعرض للبليوميسين للحث على الشيخوخة. بعد سبعة أيام ، عولجت الخلايا بـ PCC1 (100 ميكرومتر) لمدة 3 أيام للحث على موت الخلايا المبرمج. SCR ، التدافع. أناو إصابة تم تحديد التعبير باستخدام PCR الكمي مع النسخ العكسي (RT – qPCR). عولجت الخلايا بالبليوميسين للحث على الشيخوخة قبل التعرض لـ 100 ميكرومتر من PCC1 لمدة 3 أيام في غياب أو وجود 10 ميكرومتر MK2206 أو 10 ميكرومتر من ruxolitinib أو 20 نانومتر BMS-582949 لتثبيط نشاط AKT و JAK1 و / أو JAK2 أو p38 MAPK ، على التوالي. ي، مجموعة مماثلة من مقايسات التعبير RT – qPCR ل بوما باستخدام الشروط الموضحة في أنا. ل-م، قياس قابلية بقاء الخلية بعد علاج PCC1 في غياب أو وجود MK2206 (ل) ، روكسوليتينيب (إل) أو BMS-582949 (م) ، متضمنًا لتثبيط النشاط الأنزيمي لـ AKT و JAK1 و / أو JAK2 أو p38 MAPK ، على التوالي. للحصول على البيانات بتنسيق جودو ص تم حساب القيم عن طريق ANOVA أحادي الاتجاه مع مقارنة Tukey اللاحقة. دلالة إحصائية في ح-م تم حسابه باستخدام الوجهين ر-اختبارات أو ANOVA أحادية الاتجاه (اختبار Dunnett). يتم عرض البيانات في جميع الرسوم البيانية الشريطية على أنها متوسط ± sd وتمثل ثلاث مكررات بيولوجية. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01 ؛ ***ص <0.001 ؛ ****ص <0.0001. قمنا أولاً بتحليل تأثير PCC1 على التعبير على مستوى الترنسكريبتوم للخلايا الشائخة. أظهرت المعلوماتية الحيوية أن 4،406 جينًا تم تنظيمها بشكل كبير وتم تنظيم 2766 جينًا في الخلايا اللحمية بعد علاج PCC1 (الشكل التكميلي S1). 5a). لاحظنا مجموعة كبيرة من عوامل SASP ، والتي تم تنظيم التعبير عنها بشكل ملحوظ أثناء الشيخوخة الخلوية ولكن تم تقليلها إلى حد كبير عندما تعرضت الخلايا الشائخة لـ PCC1 (الشكل 1 ب). 3 ب). أظهر التنميط GSEA أن كلا من توقيعات SASP و NF- B قد تم قمعها بشكل ملحوظ بواسطة علاج PCC1 (الشكل 1 أ). 3c,d). لاحظنا أيضًا تفاعلات متبادلة متعددة أو اتصالات وظيفية بين هذه العوامل التي تم تنظيمها أثناء الشيخوخة وخاضعة للتنظيم بعد علاج PCC1 الذي يظهر في قائمة الجينات المعبر عنها تفاضليًا ، والتي كان معظمها عادةً عوامل مُفرزة (الشكل 1 ج). 3e). لفهم انتقائية PCC1 للخلايا الشائخة ، قمنا بتقييم ملف تعريف التعبير الترانسكريبتومي ولاحظنا أن PCC1 تسبب في تغيرات التعبير في عدد قليل من أفراد الأسرة الفائقة BCL-2 (الشكل. 3f). على الرغم من أن إشارات DDR ظلت غير متأثرة إلى حد كبير ، فقد لوحظ تنظيم أو تنشيط يعتمد على PCC1 للبروتين كيناز المنشط للميتوجين p38 (MAPK) ، مع حدوث انقسام كاسباس 3 في هذه الخلايا (الشكل. 3 جرام). على الرغم من أن تعبير BCL-xL كان مرتفعًا في الخلايا المتشيخة مقارنةً بتلك الموجودة في ضوابط التكاثر ، فإن علاج PCC1 لم يعزز مستوى البروتين. ظلت مستويات العاملين الآخرين BCL-2 ، وهما BCL-2 و BAX ، دون تغيير إلى حد كبير. بينما أظهر NOXA و PUMA (عضوان في مجال التماثل BCL-2 3 (BH3) -الفصيلة الفرعية المؤيدة للاستماتة فقط) أنماط تعبير مختلفة أثناء الشيخوخة الخلوية ، أدى علاج PCC1 إلى تنظيم كلا العاملين (الشكل. 3 جرام). اقترحت ضربة قاضية لعوامل BCL-2 المؤيدة لموت الخلايا المبرمج أن NOXA و PUMA توسطوا جزئيًا في إجراءات التحلل للشيخوخة لـ PCC1 (الشكل 1 ب). 3h والبيانات الموسعة الشكل. 5 أ-ج). اقترحت المعالجة بالمثبطات الكيميائية لـ AKT kinase و Janus kinase (JAK) 1 و JAK2 و p38 MAPK أيضًا مشاركة مسارات الإشارات هذه في التعبير عن PMAIP1 (إصابة) و BBC3 (بوما) وموت الخلايا المبرمج للشيخوخة بعد علاج PCC1 (الشكل. 3i–m). كما يطرق إصابة و بوما فقط جزئيًا يثبط تأثير الحالة للشيخوخة لـ PCC1 (الشكل. 3 ح ، ك - م) ، لقد بحثنا في الآلية (الآليات) المحتملة الأخرى التي تؤدي إلى موت الخلايا الشائخة. لأن البروسيانيدين يزيد عادة من قابلية بقاء الخلية ، ويقلل من إنتاج أنواع الأكسجين التفاعلية ويحد من الإجهاد التأكسدي في خلايا الثدييات37و38، سألنا بعد ذلك عما إذا كان يمكن ملاحظة تأثيرات مماثلة أو مضادات الأكسدة في الخلايا الشائخة المعرضة لـ PCC1. والمثير للدهشة أننا وجدنا أن العكس هو الصحيح ، حيث أظهرت خلايا PSC27 الشائخة مستويات مرتفعة من ROS عند معالجتها بـ PCC1 ، على عكس نظيراتها المتكاثرة (الشكل. 4 ا والبيانات الموسعة الشكل. 5d، لاحظ الإشارات من 2′-7′-dichlorodihydrofluorescein diacetate (DCFH-DA) المسبار). العلاج باستخدام HS-1793 ، وهو نظير ريسفيراترول ثابت له نشاط إزالة الجذور الحرة39، منع إنتاج ROS بشكل فعال في الخلايا الشائخة المعالجة بـ PCC1 (Extended Data Fig. 5 هـ ، ص) ، في حين تم زيادة مستويات ROS بشكل أكبر بعد تعرض الخلايا المسننة المعالجة بـ PCC1 لـ CCCP ، وهو فاصل حوي للميتوكوندريا40، أو ruxotemitide (LTX-315) ، وهو ببتيد كاتيوني أمفيباثي يحفز نفاذية الغشاء الخارجي للميتوكوندريا41، تم تطبيق كل منها بتركيزات لم تكن سامة للخلايا للتحكم في الخلايا (Extended Data Figure. 5 هـ ، ص). على الرغم من أن العلاج باستخدام CCCP أو ruxotemitide بحد ذاته تسبب أيضًا في تعزيز إنتاج ROS ، إلا أن التأثيرات كانت أقل عمومًا من تلك التي يسببها PCC1 ، مما يشير إلى أن PCC1 يتسبب في اختلال وظيفي في الميتوكوندريا في الخلايا المتقدّمة. من خلال قياس مؤشر موت الخلايا المبرمج للخلايا الشائخة (نشاط كاسباس 3/7) ، وجدنا أن التأثير الناجم عن PCC1 يمكن تحسينه بشكل أكبر عند الجمع بين PCC1 مع كل اضطراب في الميتوكوندريا ولكن قمعه عند المعالجة المشتركة مع HS-1793 (البيانات الموسعة الشكل . 5 جرام). أ، قياس مستويات ROS باستخدام DCFH-DA ، وهو مسبار فلوري نفاذي للخلايا حساس للتغيرات في حالة الأكسدة الخلوية. تم إجراء التجارب بعد يوم واحد من علاج PCC1. اليسار ، الصور التمثيلية. شريط النطاق ، 10 ميكرومتر. صحيح الإحصاء. DCF ، ثنائي كلورو ديهيدروفلوريسئين. ب، ططمة مناعية بعد تعرض الخلايا للعلاجات المختلفة. تم تحديد توزيع السيتوكروم ج بين الميتوكوندريا والسيتوبلازم عن طريق عزل الميتوكوندريا من طاف العصارة الخلوية 3 أيام بعد علاج PCC1. COX IV هو الإنزيم النهائي للسلسلة التنفسية للميتوكوندريا وعلامة الميتوكوندريا. ج، منحنيات بقاء الدورة الزمنية لتقييم قابلية بقاء خلية PSC27 عند العلاج باستخدام PCB2 ، وهو عضو آخر من عائلة procyanidin الطبيعية. يتم عرض البيانات على أنها متوسط ± sd وتم اشتقاقها من ثلاث مكررات بيولوجية (ن = 3 فحوصات مستقلة). د، يتم إجراء اختبار إنتاج ROS بطريقة مماثلة كما هو موضح في أ، باستثناء أن الخلايا تعرضت لثنائي الفينيل متعدد الكلور. شريط النطاق ، 10 ميكرومتر. و، طخة مناعية لتعبير وتوزيع أجهزة الصراف الآلي ، p53 و caspase 3 بين السيتوبلازم والنواة. GAPDH و lamin A / C ، ضوابط تحميل السيتوبلازم والنواة ، على التوالي. C1 ، PCC1 ؛ B2 ، PCB2. F، الفحص المجهري متحد البؤر لتلطيخ التألق المناعي بعد علاج الخلايا بالمركبة (DMSO) أو PCC1. تم تطبيق الأجسام المضادة الأولية الخاصة بـ p53 أو COX IV. شريط النطاق ، 10 ميكرومتر. ز، تحليل اللطخة المناعية لخلايا PSC27 المعرضة لعوامل مختلفة. السيتوبلازم. ميتو ، ميتوكوندريا. ح، تحليل تلطيخ JC-1 ، مسبار الفلورسنت يدل على ميكرومتر. تم قياس الإشارات على مدى 3 د. يشير التألق الأخضر إلى مونومرات JC-1 (تظهر في العصارة الخلوية بعد إزالة الاستقطاب من غشاء الميتوكوندريا وتشير إلى مرحلة مبكرة من موت الخلايا المبرمج). يشير التألق الأحمر إلى تجمع JC-1 (يتواجد في الميتوكوندريا السليمة). اليسار ، الصور التمثيلية. صحيح الإحصاء. تم استخدام كل من PCC1 و PCB2 عند 100 ميكرومتر في الاختبارات ذات الصلة. إدخال المعلومات بوو-ز تمثل ثلاث تجارب مستقلة. دلالة إحصائية في أ (الصحيح)، د (يمين) و ح (يمين) تم حسابه باستخدام الوجهين ر-الاختبارات ، وذلك في ج تم حسابه باستخدام ANOVA أحادي الاتجاه (اختبار Dunnett). يتم عرض البيانات في جميع الرسوم البيانية الشريطية على أنها متوسط ± sd وتمثل ثلاث مكررات بيولوجية. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01. يعد إطلاق السيتوكروم ج واضطراب غشاء الميتوكوندريا أحداثًا داخل الخلايا مرتبطة بموت الخلايا المبرمج وغالبًا ما تعمل كدوافع مباشرة لموت الخلايا المبرمج42. تشير بياناتنا إلى أن علاج PCC1 عزز إطلاق السيتوكروم ج من الميتوكوندريا إلى الفضاء السيتوبلازمي المحيط (الشكل. 4 ب والبيانات الموسعة الشكل. 5 ح). يتوافق إطلاق السيتوكروم ج من الميتوكوندريا إلى حد كبير مع التفاعلات الكيميائية الحيوية مثل تنشيط الكاسبيز في الخلايا المتشيخة المعالجة بـ PCC1 (الشكل. 3 جرام). يُظهر أفراد عائلة بروسيانيدين مجموعة واسعة من الخصائص الدوائية بما في ذلك مضادات الأكسدة ومضادات الالتهاب ، وهي عكس ما لاحظناه عند علاج الخلايا الشائخة باستخدام PCC1. دفعتنا البيانات الحالية إلى التفكير فيما إذا كانت تأثيرات PCC1 تتكاثر بواسطة بروسيانيدينات أخرى. Procyanidin B2 (PCB2) عبارة عن فلافونويد تمثيلي موجود على شكل ثنائى ويقلل من مستويات ROS أثناء الإجهاد التأكسدي في الخلايا المستنبتة43. فشل PCB2 في القضاء على الخلايا الشائخة (الشكل. 4 ج والتين التكميلي. 3 ب و 4 ب) ولا يحسن إنتاج ROS ولا يحفز إطلاق الميتوكوندريا للسيتوكروم ج في الخلايا الشائخة (الشكل. 4 د والبيانات الموسعة الشكل. 5i). كمية كبيرة من p65 (RelA) ، واحدة من الوحدات الفرعية الرئيسية لمركب NF-B ، تم نقلها إلى نواة الخلايا الشائخة (الشكل. 4 هـ). على الرغم من أن معالجة PCB2 تصدت للإزاحة النووية لـ p65 ، وهو ما يتوافق مع قدرتها المضادة للالتهابات ، إلا أن هذا التأثير لم يتكرر بواسطة PCC1 (الشكل 1 ب). 4 هـ). أظهرت الخلايا الشائخة التي تعرضت لـ PCC1 انقسامًا ملحوظًا في caspase 3 ، في حين أن تلك التي عولجت بـ PCB2 لم تفعل ذلك ، مما زاد من التمييز بين النشاط البيولوجي لهذين الجزيئين من procyanidin (الشكل 1 ب). 4 هـ). كعامل يتحكم وظيفيًا في مصير الخلية ، يمكن لـ p53 إحداث موت الخلايا المبرمج إما عن طريق التعامل مع الجينات المؤيدة للاستماتة أو بطريقة مستقلة عن النسخ عن طريق الانتقال إلى الميتوكوندريا44. لاحظنا زيادة الانتقال النووي لـ p53 عند الشيخوخة الخلوية ، وهو نمط تم تقليله بشكل ملحوظ بواسطة PCC1 ، ولكنه أقل بكثير من ذلك بواسطة PCB2 (الشكل 1 ب). 4 هـ ، ص). نظرًا لأن الاستبعاد النووي لـ p53 يعد خطوة حاسمة في تحريض موت الخلايا المبرمج للخلايا الشائخة45، قمنا بتقييم توزيع p53. أشار تلطيخ التألق المناعي إلى زيادة تداخل البروتين p53 بشكل كبير مع الوحدة الفرعية للسيتوكروم سي أوكسيديز IV (COX IV) (مركب بروتين عبر الغشاء في سلسلة الإلكترون التنفسي للميتوكوندريا ، وغالبًا ما يستخدم كعلامة بروتين مقيم في الميتوكوندريا) في الخلايا الشائخة المعالجة بـ PCC1 ، مما يشير إلى تحسين الانتقال من p53 في مصفوفة الميتوكوندريا. على الرغم من أننا لاحظنا بعض p53 في الميتوكوندريا للخلايا المتكاثرة ، إلا أن PCC1 لم يحفز تدفقًا ملحوظًا أو شاملًا لبروتين p53 إلى مصفوفة الميتوكوندريا للخلايا المتكاثرة (الشكل. 4f). ومع ذلك ، في الخلايا الشائخة ، انخفضت مستويات p53 في النوى ولكنها زادت في الميتوكوندريا عند التعرض لـ PCC1 (الشكل 1 ب). 4 جرام). انخفاض احتمالية غشاء الميتوكوندريا (ميكرومتر) هو حدث يمكن أن يؤدي إلى موت الخلايا المبرمج من خلال المسار الجوهري بوساطة الميتوكوندريا46. وجدنا أن ميكرومتر قد انخفض بشكل كبير في الخلايا المتشيخة ، بينما بقيت الخلايا المتكاثرة غير متأثرة بشكل أساسي في وجود PCC1 ، كما يتضح من ملف تعريف إشارات مسبار JC-1 (الشكل 1 ج). 4 ح). وبالتالي ، فإن PCC1 يعزز توليد ROS ، ويؤدي إلى إطلاق السيتوكروم c ويسبب اضطرابًا في الخلايا الشائخة ، والأحداث المرتبطة بطبيعتها بإعاقة الميتوكوندريا وموت الخلايا المبرمج وظيفيًا. تشير بياناتنا التجريبية معًا إلى أن الخلايا الشائخة تخضع لموت الخلايا المبرمج الناجم عن PCC1 ، وهي عملية يتم التوسط فيها جزئيًا بواسطة إصابة و بوما upregulation والمرتبطة بتحسين إنتاج ROS واختلال وظائف الميتوكوندريا. نظرًا لقدرة وانتقائية PCC1 للتخلص من الخلايا الشائخة في المختبر ، استفسرنا بعد ذلك عما إذا كان يمكن استغلال هذا العامل للتدخل ضد الأمراض المرتبطة بالعمر في الجسم الحي. في علم الأورام السريري ، تحد مقاومة الأدوية من فعالية معظم العلاجات المضادة للسرطان ، بينما تساهم الخلايا الشائخة في كثير من الأحيان في المقاومة العلاجية من خلال تطوير SASP داخل الجسم الحي في البيئة الدقيقة للورم المتضرر بالأدوية (TME)15و16و47. يقلل التخلص الدوائي من الخلايا المتشيخة الناتجة عن العلاج من الآثار الجانبية للعلاج الكيميائي ويمنع تكرار الإصابة بالسرطان في الحيوانات48. ومع ذلك ، فإن جدوى استنفاد الخلايا الشائخة بوساطة PCC1 من الأورام الأولية لتعزيز فعالية العلاجات المضادة للسرطان لا تزال غير معروفة إلى حد كبير. أولاً ، اخترنا بناء مواد مؤتلفة للأنسجة عن طريق مزج خلايا PSC27 بخلايا PC3 ، وهي خط خلايا سرطان البروستاتا النموذجي ذي الأورام الخبيثة العالية ، بنسبة مُحسَّنة مسبقًا (1: 4)14. ثم تم زرع الخلايا تحت الجلد في الخاصرة الخلفية من الفئران المصابة بداء السكري غير البدينين ونقص المناعة المشترك الشديد (NOD-SCID). تم قياس أورام الحيوانات في نهاية فترة 8 أسابيع ، وتم الحصول على الأنسجة للتقييم المرضي. مقارنة بالأورام التي تتكون من خلايا سرطانية PC3 وخلايا انسجة PSC27 ساذجة ، أظهرت الطعوم xenografts المكونة من خلايا PC3 وخلايا PSC27 الشائخة زيادة كبيرة في الحجم ، مما يؤكد التأثيرات المعززة لنمو الورم للخلايا الشائخة (البيانات الموسعة الشكل. 6 أ). لتقليد الظروف السريرية ، قمنا بتصميم تجريبي لنظام ما قبل السريري يشتمل على العلاجات السامة للجينات و / أو الأدوية الحالة للشيخوخة (الشكل. 5a). بعد أسبوعين من الزرع تحت الجلد ، عندما لوحظ امتصاص مستقر للأورام في الجسم الحي ، تم تسليم جرعة واحدة من ميتوكسانترون (عقار علاجي كيميائي) أو دواء وهمي للحيوانات في اليوم الأول من الأسبوع الثالث والخامس والسابع حتى نهاية الأسبوع. نظام 8 أسابيع (Extended Data Fig. 6 ب). على عكس المجموعة التي عولجت بالدواء الوهمي ، أدت إدارة معهد ماساتشوستس للتكنولوجيا إلى تأخير ملحوظ في نمو الورم ، مما أدى إلى التحقق من فعالية معهد ماساتشوستس للتكنولوجيا كعامل علاج كيميائي (انخفاض بنسبة 44.0 ٪ في حجم الورم) (الشكل. 5 ب). بشكل ملحوظ ، على الرغم من أن إعطاء PCC1 نفسه لم يتسبب في تقلص الورم ، إلا أن العلاج باستخدام MIT متبوعًا بإعطاء PCC1 (عند 20 مجم لكل كجم عن طريق الحقن داخل الصفاق (IP) بعد أسبوعين من جرعة MIT الأولى ثم يتم تسليمه كل أسبوعين) تحسن بشكل ملحوظ من تراجع الورم (55.2) انخفاض في حجم الورم مقارنةً بـ MIT وحده ؛ انخفاض بنسبة 74.9٪ في حجم الورم مقارنةً بالعلاج الوهمي) (الشكل. 5 ب). أ، رسم تخطيطي توضيحي لنظام ما قبل السريرية. بعد أسبوعين من الغرس تحت الجلد والامتصاص في الجسم الحي لمؤتات الأنسجة ، تلقت ذكور الفئران NOD-SCID إما عوامل فردية (أحادية) أو مجمعة (مزدوجة) في جدول زمني مؤلف من عدة دورات. BLI ، تصوير تلألؤ بيولوجي. ب، التنميط الإحصائي لأحجام نهاية الورم. تم تطعيم خلايا PC3 بمفردها أو مع خلايا PSC27 في الجناح الخلفي للحيوانات. ج، تقييم مقارن للشيخوخة في الجسم الحي بواسطة تلطيخ SA-β-Gal. تم تشريح الأورام حديثًا بعد قتل الحيوانات ومعالجتها كأقسام مجمدة للتلوين النسيجي. أشرطة مقياس ، 200 ميكرومتر. د، مؤامرات الكمان تصور الإحصاءات المقارنة لتلطيخ SA-β-Gal في أنسجة الورم. و، فحص النسخ للتعبير في الجسم الحي للعديد من عوامل SASP الكنسي في الخلايا اللحمية المعزولة من الأورام. تعرضت الأنسجة المأخوذة من الحيوانات التي تم طعها بالخلايا السرطانية والخلايا اللحمية للعزل المدعوم بالتشريح الدقيق بالليزر والعمليات اللاحقة. تمثل البيانات ثلاث مكررات بيولوجية (ن = 10 حيوانات لكل مجموعة). يتم عرض مجموعات البيانات كمخططات مربع وشعر ، حيث يمتد المربع من 25 إلى 75 مئوية مع عرض الوسيط كخط في المنتصف والشعيرات تشير إلى القيم الأصغر والأكبر. F، التنميط من نصوص SASP في الخلايا اللحمية. تم تطبيع الإشارات المقابلة لكل عامل لتلك من المجموعة المعالجة بالمركبة. ملحوظة ص 16INK4a يُعرف أيضًا باسم CDKN2A و ص 21CIP1 يُعرف أيضًا باسم CDKN1A. ز، القياس الإحصائي للخلايا المصابة بتلف الحمض النووي والخلايا المبرمجة في العينات الحيوية التي تم جمعها على النحو الموصوف في أوب. يتم تقديم القيم كنسبة مئوية من الخلايا الملطخة إيجابياً بالكيمياء المناعية (IHC) مع الأجسام المضادة الخاصة بالهيستون γH2AX أو كاسباس 3 (المشقوق). ل بود-زو ص تم حساب القيم على الوجهين ر- الاختبارات. ح، صور الممثل IHC لـ caspase 3 (المشقوق ، CC3) في نهاية الأنظمة العلاجية. أشرطة مقياس ، 100 ميكرومتر. أنا، البقاء على قيد الحياة المقارن للفئران المقتولة بعد تطور الأمراض الكبيرة الحجم المتقدمة. تم حساب مدة البقاء على قيد الحياة من وقت حقن الأنسجة المؤتلفة حتى موت الحيوان. MS ، متوسط البقاء على قيد الحياة. ص تم حساب القيم عن طريق اختبارات الترتيب اللوغاريتمي على الوجهين (Mantel-Cox). إدخال المعلومات جوح تمثل ثلاث تجارب مستقلة. يتم عرض البيانات في جميع الرسوم البيانية الشريطية على أنها متوسط ± sd وتمثل ثلاث مكررات بيولوجية. اختبرنا بعد ذلك ما إذا كان شيخوخة الخلايا قد حدث في بؤر الورم لهذه الحيوانات. ليس من المستغرب أن تسببت إدارة معهد ماساتشوستس للتكنولوجيا في ظهور عدد كبير من الخلايا المتشيخة في أنسجة الورم. ومع ذلك ، فإن توصيل PCC1 لهذه الحيوانات المعالجة بالعلاج الكيميائي أدى إلى استنفاد غالبية الخلايا الشائخة (الشكل 1 ب). 5 ج ، د). أشار التشريح الدقيق لالتقاط الليزر متبوعًا بمقايسات النسخ إلى زيادة كبيرة في التعبير عن عوامل SASP بما في ذلك IL6و CXCL8و سبينك 1و WNT16B (المعروف أيضًا باسم WNT16) ، GM-CSF (المعروف أيضًا باسم CSF2) ، MMP3 و IL1A، وهو اتجاه يرافقه تنظيم الجين المشفر لعلامة الشيخوخة p16INK4a في الحيوانات المعالجة بالعلاج الكيميائي (الشكل. 5e والبيانات الموسعة الشكل. 6 ج). لوحظت هذه التغييرات بشكل رئيسي في الخلايا اللحمية ، بدلاً من الخلايا السرطانية المجاورة ، مما يشير إلى إمكانية إعادة توطين الخلايا السرطانية المتبقية ، والتي كثيرًا ما تطور مقاومة مكتسبة في TME التالفة من العلاج. ومع ذلك ، عند إدارة PCC1 ، تم عكس التغييرات المرتبطة بـ SASP إلى حد كبير ، كما هو مقترح بواسطة فحوصات النسخ و RNA-seq (الشكل 1 ب). 5f والبيانات الموسعة الشكل. 6 د). لاستكشاف الآليات الكامنة وراء تعبير SASP في الفئران المعالجة بمعهد ماساتشوستس للتكنولوجيا ، قمنا بتشريح الأورام من الحيوانات التي عولجت بهذين العاملين بعد 7 د من الجرعة الأولى من إيصال GSE ، وهي نقطة زمنية قبل تطور المستعمرات المقاومة. على عكس العلاج الوهمي ، زادت إدارة معهد ماساتشوستس للتكنولوجيا من تلف الحمض النووي وموت الخلايا المبرمج ، في حين أن العلاج باستخدام PCC1 وحده لم يفعل (الشكل. 5 جرام). ومع ذلك ، عندما تمت إدارة PCC1 للحيوانات المعالجة بمعهد ماساتشوستس للتكنولوجيا بشكل مشترك ، تم زيادة تلف الحمض النووي وموت الخلايا المبرمج بشكل كبير ، مما يعني تعزيز السمية الخلوية في الحيوانات التي تتلقى العلاج الكيميائي ومزيلات الشيخوخة. كدليل داعم ، لاحظنا انقسام كاسباس 3 المرتفع ، وهو سمة مميزة نموذجية لموت الخلايا المبرمج الخلوي ، عندما تم إعطاء PCC1 جنبًا إلى جنب مع MIT (الشكل 1 ب). 5 ح). قمنا بعد ذلك بتقييم عواقب تطور الورم من خلال مقارنة بقاء مجموعات الحيوانات المختلفة بمرور الوقت. في هذه المجموعة قبل السريرية ، تمت مراقبة الحيوانات لنمو الورم ، مع اعتبار المرض الضخم قد نشأ بمجرد أن كان عبء الورم بارزًا (الحجم ≥ 2000 مم3) ، وهو نهج مستخدم في الدراسات السابقة14و49. أظهرت الفئران التي تلقت العلاج التوافقي MIT-PCC1 متوسط البقاء على قيد الحياة لفترات طويلة ، حيث بقيت على قيد الحياة أطول بنسبة 48.1 ٪ على الأقل من المجموعة التي عولجت بـ MIT وحده (الشكل 1 ب). 5iوالأخضر مقابل الأزرق). ومع ذلك ، فإن علاج PCC1 وحده يطيل فترة البقاء بشكل هامشي. تشير بياناتنا إلى أن إدارة PCC1 وحدها لا تغير نمو الورم ولا تعزز بقاء الحيوان ، في حين أن الإدارة المشتركة لـ PCC1 مع MIT لها تأثيرات تآزرية كبيرة. من الجدير بالملاحظة أن العلاجات التي أجريت في هذه الدراسات يبدو أنها تتحملها الحيوانات جيدًا ، حيث لم يلاحظ وجود اضطرابات كبيرة في مستويات اليوريا أو الكرياتينين أو إنزيم الكبد أو وزن الجسم (Extended Data Fig. 6 هـ ، ص). والأهم من ذلك ، أن عوامل العلاج الكيميائي والوقاية من الشيخوخة التي يتم تناولها بجرعات محسّنة في هذه الدراسة لم تتداخل بشكل كبير مع سلامة الجهاز المناعي أو تجانس الأنسجة للأعضاء الحيوية ، حتى في الفئران ذات الكفاءة المناعية (الشكل التكميلي 1 ب). 6 أ-ج). تدعم هذه النتائج الأساس المنطقي بأن العوامل المضادة للشيخوخة جنبًا إلى جنب مع العلاج الكيميائي التقليدي لديها القدرة على تعزيز استجابة الورم دون التسبب في سمية جهازية شديدة. يمكن حتى لعدد صغير من الخلايا الشائخة إحداث خلل وظيفي في الحيوانات الصغيرة50. سألنا ما إذا كان PCC1 يقتل بشكل انتقائي الخلايا الشائخة في الجسم الحي وبالتالي يمكنه منع الخلل الوظيفي الجسدي. لمعالجة هذا السؤال ، أجرينا غرسًا متوازيًا للأرومات الليفية الجنينية للفأر المتحكم والشيخوخة (MEFs ، 0.5 × 10).6 خلايا لكل جانب) معربًا بشكل أساسي عن لوسيفيراز (LUC+) تحت الجلد في الفئران البرية من النوع (WT). مباشرة بعد الزرع ، عولجت الحيوانات بـ PCC1 (عند 20 مجم لكل كيلوغرام عن طريق الحقن عبر بروتوكول الإنترنت) أو بمركبة (إيثانول - بولي إيثيلين جلايكول 400 –فوسال 50 بروبيلين جلايكول (PG) عند 10:30:60) لمدة 7 أيام (الشكل. 6 أ). وجدنا أن شدة إشارة التلألؤ كانت أقل بشكل ملحوظ في الفئران المزروعة بخلايا شيخوخة وعولجت بـ PCC1 عن تلك الموجودة في الزملاء الذين عولجوا بالمركبات ، على الرغم من عدم ملاحظة أي فرق بعد علاج الفئران المزروعة باستخدام LUC+ خلايا التحكم (الشكل. 6 ب ، ج) ، وإثبات فعالية الحالة للشيخوخة لـ PCC1 في الجسم الحي. أ، رسم تخطيطي للإجراءات التجريبية لزرع الخلايا واختبارات الوظيفة البدنية في فئران ذكور C57BL / 6J عمرها 5 أشهر. ب، تظهر الصور التمثيلية في نشاط لوسيفيراز الحي 2 د بعد العلاج الأخير للفئران. قضبان مقياس ، 20 مم. ج، تألق الخلايا المزروعة كنسبة مئوية بالنسبة لمتوسط الإشارات في الحيوانات المعالجة بالمركبات. د-F، قياس السرعة القصوى للمشي (بالنسبة لخط الأساس) (د) ، التحمل المعلق (و) وقوة القبضة (F) في الفئران الذكور C57BL / 6J البالغة من العمر 5 أشهر ، مع إجراء الاختبارات بعد شهر واحد من آخر علاج. ز، رسم تخطيطي للتصميم التجريبي لعمليات الزرع وقياسات الوظائف الفيزيائية. ح-ي، قياس السرعة القصوى للمشي (بالنسبة لخط الأساس) (ح) ، التحمل المعلق (أنا) وقوة القبضة (ي) في الفئران الذكور C57BL / 6J البالغة من العمر 28 أسبوعًا (أسبوعين بعد آخر علاج). ل، منحنيات البقاء على قيد الحياة لمدة عام واحد لحيوانات عمرها 17 شهرًا مزروعة بـ 0.5 × 106 التحكم في خلايا MEF ومعالجتها بالمركبة (مركبة CTRL) والفئران المزروعة بـ 0.5 × 106 خلايا MEF الشائخة المعالجة إما بالمركبة (مركبة SEN) أو PCC1 (SEN-PCC1). رؤوس سهام حمراء ، زرع خلية (في اليوم 528 من العمر) أو قياس نهاية البقاء على قيد الحياة (890 يومًا من العمر). ص تم حساب القيم عن طريق اختبارات الترتيب اللوغاريتمي على الوجهين (Mantel-Cox). إل، القياس الكمي المقارن لعبء المرض (يسار) وعبء الورم (يمين) (يظهر كمتوسط مع المدى الربيعي) بعد زرع الخلايا الشائخة والعلاج بالمركبة أو PCC1. م، سبب موت الحيوانات التي تم زرع خلايا لها وتم علاجها بالمركبة أو PCC1. ل د-Fوح-ي، يتم عرض البيانات كمخططات مربعة وشعيرات ، حيث تمتد المربعات من 25 إلى 75 مئوية مع عرض الوسيط كخط في المنتصف ، وتشير الشعيرات إلى القيم الأصغر والأكبر. ل ج-Fوح-يو ص تم حساب القيم على الوجهين ر- الاختبارات. عدد الحيوانات ن = 5 لكل مجموعة ل جو ن = 10 لكل مجموعة ل د-يو ن = 27 من أجل ل و ن = 13 من أجل إلوم. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01 ؛ ***ص <0.001 ؛ ****ص <0.0001. قمنا بعد ذلك بالتحقيق فيما إذا كان قتل الخلايا الشائخة المزروعة باستخدام PCC1 يمكن أن يخفف من الأحداث المرضية ، وخاصة الخلل الوظيفي الجسدي. علاج الحيوانات الصغيرة بـ PCC1 بعد زرع الخلايا الشائخة لمدة أسبوع يمنع حدوث انخفاض في سرعة المشي القصوى (RotaRod) والتحمل المعلق (اختبار التعليق) وقوة القبضة (مقياس القبضة) ، التغييرات التي لوحظت في غضون شهر واحد بعد علاج السيارة لمجموعة أخرى من الفئران الحاملة الخلايا الشائخة ، بما يتوافق مع إمكانات PCC1 لتقليل الخلل الوظيفي الجسدي (الشكل. 6d – f). منع إعطاء PCC1 أيضًا الخلل الوظيفي الجسدي الذي حدث في الحيوانات بعد 5 أسابيع من زرع الخلايا الشائخة (الشكل 4 ج). 6 جرام). في الفئران التي تأوي خلايا شيخوخة ، حسنت دورة علاجية واحدة مدتها 5 أيام من علاج PCC1 الوظيفة الجسدية مقارنةً بمعالجة السيارة (الشكل 1 ب). 6 صباحا - د). تجدر الإشارة إلى أن التحسن كان قابلاً للاكتشاف بعد أسبوعين من علاج PCC1 واستمر لعدة أشهر (Extended Data Figure. 7a,b). في هاتين النقطتين الزمنيتين من إعطاء PCC1 (مباشرة مقابل 5 أسابيع بعد زرع الخلايا الشائخة) ، يبدو أن الآثار المفيدة لـ PCC1 قابلة للمقارنة. تشير البيانات إلى أن الجدول الزمني لإدارة PCC1 قد يكون مرنًا ، مما يدل على جدواه السريرية المحتملة. نظرًا لأن البروسيانيدينات المشتقة من النبات عادةً ما يكون لها فترات نصف عمر للتخلص من أقل من 12 ساعة51و52، فإن هذا التحسن المستمر في الوظيفة البدنية بعد دورة واحدة من علاج PCC1 يلغي الحاجة إلى العلاج المستمر بعامل الحالة للشيخوخة ، مما يعني أيضًا أن نشاط PCC1 كافٍ لتفادي الخلل الوظيفي الجسدي الناجم عن الخلايا المتشيخة. سعينا بعد ذلك إلى تقييم تأثير الخلايا الشائخة أو فائدة التخلص منها في الحيوانات في منتصف العمر. لهذا الغرض ، استخدمنا الفئران C57BL / 6J البالغة من العمر 17 شهرًا ، والتي تم زرعها باستخدام MEFs للتحكم أو الشيخوخة. والجدير بالذكر أن بقاء الحيوانات التي تحمل خلايا شيخوخة وتتلقى العلاج من المركبات في العام التالي كان أقل بكثير من نظرائها الذين يتلقون علاج PCC1 ، مع ارتفاع خطر الموت بمقدار 2.4 ضعف (نسبة الخطر ، ص = 0.0172) (الشكل. 6 كيلو). ومع ذلك ، لم يكن عبء المرض وعبء الورم عند الوفاة وأسباب الوفاة مختلفين بشكل كبير بين الفئران التي عولجت بالمركبة وتلك التي عولجت بـ PCC1 (الشكل 1 ب). 6 لتر ، م). تشير هذه البيانات إلى أن عددًا صغيرًا من الخلايا الشائخة قد يؤثر على البقاء من خلال عملية عامة ، مثل تسريع تقدم الشيخوخة ، بدلاً من التسبب في أي أمراض معينة أو حالات فردية قليلة. تؤدي زيادة عبء الخلايا الشائخة إلى اختلال وظيفي جسدي ، وهو اتجاه يرتبط بوفيات منتصف العمر ولكن يمكن تأجيله عن طريق إعطاء أدوية الحالة للشيخوخة مثل PCC1. تستنفد الأدوية الحالة للشيخوخة الخلايا المتشيخة في الأنسجة والأعضاء المتنوعة في مختلف الحالات الفيزيولوجية المرضية ، والتي يرتبط معظمها بالشيخوخة53. لمزيد من فحص تأثير PCC1 على الخلايا الشائخة في الكائنات الحية وشيخوخة الكائن الحي ، اخترنا نموذجين حيوانيين مستقلين للشيخوخة في الجسم الحي ، بما في ذلك الفئران التي تواجه تحديات العلاج والفئران التي تتقدم في العمر بشكل طبيعي. أولاً ، تسببنا في شيخوخة الخلايا عن طريق تعريض فئران WT لإشعاع كامل الجسم (WBI) بجرعة شبه مميتة (5 Gy) ، وهي خطوة يتبعها علاج مضاد للشيخوخة باستخدام PCC1 (20 مجم لكل كجم عن طريق الحقن IP) أو مركبة (إيثانول - بولي إيثيلين) glycol 400 – Phosal 50 PG at 10:30:60) (مرة واحدة في الأسبوع) (الشكل. 7a). من الجدير بالذكر أن الحيوانات التي خضعت لـ WBI أظهرت مظهرًا غير طبيعي للجسم ، بما في ذلك الشعر الرمادي الملحوظ ، والذي تم عكسه إلى حد كبير عن طريق إدارة PCC1 (الشكل. 7b,c). تم إحداث خلايا شيخوخة SA-β-Gal-إيجابية في الجسم الحي في هذه الحيوانات ، كما يتضح من زيادة إيجابية التلوين في أنسجة القلب والرئة (الشكل 1 ب). 7d,e). ومع ذلك ، عندما تعاملنا مع PCC1 عن طريق الحقن عبر بروتوكول الإنترنت ، انخفضت بشكل كبير النسبة المئوية للخلايا الإيجابية SA-β-Gal في الأنسجة التي تم تشريحها ، على عكس الفئران التي عولجت بالمركبة في مرحلة ما بعد WBI (الشكل 1 ب). 7 و ، ز). قلل علاج PCC1 أيضًا من التعبير عن علامات الشيخوخة ومجموعة فرعية من عوامل SASP الرئيسية مقارنةً بمعالجة السيارة (الشكل. 7h). باختصار ، تشير البيانات إلى أن PCC1 يمكن أن يستنفد بشكل فعال الخلايا الإيجابية SA-β-Gal ، ويتحكم في تعبير SASP ويقلل من عبء الخلايا المتشيخة في ظل ظروف الجسم الحي في الفئران. أ، رسم تخطيطي للإجراء التجريبي للفئران التي تعاني من الطيور البرية مؤشر واختبارات الوظيفة البدنية. ب، مقارنة لقطة لكامل الجسم لفئران ذكور C57BL / 6J كانت ساذجة ، وتعرضت لـ WBI متبوعة بمعالجة مركبة أو تعرضت لـ WBI وعولجت بـ PCC1 ، على التوالي. ج، صورة داخل قفص لحيوانات موصوفة في أ تحت ظروف ما قبل السريرية. د، صور تمثيلية لتلطيخ SA-β-Gal لأنسجة القلب من الفئران غير المعالجة (الساذجة) والمعالجة بالـ WBI المعرضة للعلاج بالمركبة أو PCC1. شريط النطاق ، 200 ميكرومتر. و، صور تمثيلية لتلطيخ SA-β-Gal للأنسجة الرئوية للفئران كما هو موضح في د. شريط النطاق ، 200 ميكرومتر. F، دراسة إحصائية مقارنة لتلطيخ SA-β-Gal لأنسجة القلب للحيوانات في د. ز، دراسة إحصائية مقارنة لتلطيخ SA-β-Gal للأنسجة الرئوية للحيوانات في و. ح، القياس الكمي لتعبير SASP على مستوى النسخ في الأنسجة التي تم جمعها من الحيوانات المعالجة في ظل الظروف الموضحة في أ. أناوي، قياس مسافة الجري بجهاز المشي (أنا) وقوة القبضة (ي) من الفئران التجريبية. ل F-يو ص تم حساب القيم على الوجهين ر- الاختبارات. ل، تحليل بقاء Kaplan-Meier لفئران C57BL / 6J التي تعرضت ل WBI وعولجت أسبوعياً بالمركبة أو PCC1 ، مع الفئران الساذجة كعنصر تحكم غير معالج. CI ، فاصل الثقة ؛ نسبة الخطر للموارد البشرية DFI ، فترة خالية من الأمراض. ص تم حساب القيم عن طريق اختبارات الترتيب اللوغاريتمي على الوجهين (Mantel-Cox). يتم عرض البيانات في الرسوم البيانية الشريطية على أنها متوسط ± sd وتمثل ثلاث تجارب مستقلة. NS ، ص > 0.05 ؛ *ص <0.05 ؛ **ص <0.01 ؛ ***ص <0.001 ؛ ****ص <0.0001. ثم قمنا بتقييم تأثير العلاجات قبل السريرية على المعلمات الفيزيائية للفئران. كما هو متوقع ، قلل WBI بشكل كبير من قدرة التمرين وقوة العضلات كما تم قياسها بواسطة جهاز المشي ومقايسات قوة القبضة في مجموعة المركبات (الشكل. 7i,j). على النقيض من ذلك ، قدمت إدارة PCC1 فائدة كبيرة ، واستعادة هذه القدرات. الأهم من ذلك ، أن علاج PCC1 زاد من معدل البقاء على قيد الحياة (الشكل. 7k). تشير نتائجنا إلى أن التخلص من الخلايا الشائخة الإيجابية التي يسببها PCC1 يمكن أن يكون استراتيجية فعالة للتخفيف من الانحدار الجسدي المرتبط بالشيخوخة وتقليل الوفيات في أماكن الشيخوخة المبكرة الناتجة عن الضغوطات البيئية مثل العلاج السام للخلايا. سعينا بعد ذلك إلى تحديد تأثير الخلايا الشائخة على الوظيفة الجسدية في الحيوانات التي تتقدم في السن بشكل طبيعي. لهذا الغرض ، عالجنا فئران WT عادية عمرها 20 شهرًا بمركبة (إيثانول - بولي إيثيلين جلايكول 400 –فوسال 50 PG عند 10:30:60) أو PCC1 (20 مجم لكل كجم عن طريق الحقن IP) (مرة كل أسبوعين) لمدة 4 أشهر (الشكل. 8 أ). كشف التقييم النسيجي عن وجود نسبة مرتفعة بشكل ملحوظ من الخلايا الشائخة إيجابية SA-β-Gal في الكلى والكبد والرئة والبروستات للحيوانات المسنة ، والتي انعكست بواسطة علاج PCC1 (الشكل 1 ب). 8 ب ، ج والبيانات الموسعة الشكل. 8a-f). أظهرت نتائج الاختبارات البدنية أن PCC1 خفف من الخلل الوظيفي الجسدي عن طريق تعزيز سرعة المشي القصوى ، والتحمل المعلق ، وقوة القبضة ، والتحمل على جهاز المشي ، والنشاط اليومي وأداء توازن الحزمة للحيوانات التي خضعت لـ PCC1 مقارنة بتلك التي عولجت بالمركبة (الشكل 1). 8d – i) ، ظل وزن الجسم وتناول الطعام دون تغيير إلى حد كبير في الفئران المعالجة بـ PCC1 (Extended Data Figure. 8 جرام ، ح). والجدير بالذكر أن التعبير عن SASP انخفض بشكل كبير في الأنسجة مثل رئتي الفئران المسنة التي عولجت بـ PCC1 مقارنةً بالمجموعة التي عولجت بالمركبة (الشكل 1 ب). 8j) ، وهو نمط يتوافق مع إفراز أقل لعوامل SASP بواسطة أنسجة اللحمة البشرية المعالجة بـ PCC1 (الشكل. 5f). أ، تصميم تخطيطي للفحص البدني للفئران الذكور C57BL / 6J البالغة من العمر 20 شهرًا والتي عولجت بـ PCC1 مرة كل أسبوعين (كل أسبوعين) لمدة 4 أشهر. ب، صور تمثيلية لتلطيخ SA-β-Gal للكلى من فئران شابة وكبار السن عولجت بالمركبة أو PCC1. شريط النطاق ، 200 ميكرومتر. ج، التحديد الكمي لتلطيخ SA-β-Gal كما هو موضح في ب. تمثل البيانات يعني ± sd د-ح، التحديد الكمي لسرعة المشي القصوى (نسبة إلى خط الأساس) (د) ، التحمل المعلق (و)، قبضة قوية (F) ، جهاز المشي (ز) والنشاط اليومي (ح) من الفئران الذكور C57BL / 6J البالغة من العمر 20 شهرًا بعد العلاج لمدة 4 أشهر. أنا، القياس الكمي للوقت اللازم لعبور عارضة التوازن. ترتبط نقاط البيانات قبل وبعد العلاج لكل حيوان للسماح بإجراء مقارنة مباشرة لتأثيرات العلاج. ي، التنميط الكمي للنصوص لتعبير SASP في أنسجة الرئة التي تم جمعها من 6 أشهر من العمر غير المعالج (6M) ، 24 شهرًا من المركبات المعالجة (24M مركبة) و 24 شهرًا من الفئران المعالجة بـ PCC1 (24M-PCC1) . يتم عرض البيانات على أنها متوسط ± sd وتم اشتقاقها من ثلاث مكررات بيولوجية (ن = 3 فحوصات مستقلة). ل، تصميم تخطيطي لتحليلات عمر الفئران (كلا الجنسين) في عمر 24-27 شهرًا. إلوم، البقاء على قيد الحياة بعد العلاج (إل) والبقاء على قيد الحياة مدى الحياة (م) منحنيات الحيوانات C57BL / 6J المعالجة كل أسبوعين باستخدام PCC1 (ن = 91 ؛ 48 ذكور 43 إناث) أو مركبة (ن = 80 ؛ 42 ذكور و 38 إناث) بدءًا من عمر 24 إلى 27 شهرًا. ن، متوسط سرعة المشي القصوى والتحمل المعلق خلال الشهرين الأخيرين من العمر (ن = 10 فئران لكل مجموعة) وعمر أطول الفئران عمرا (أعلى 20) في كلا المجموعتين. الوعبء المرض وعبء الورم عند الوفاة. لكلا الجنسين ، ن = 60 فأر لكل ذراع. للذكور، ن = 31 لـ PCC1 و ن = 33 للمركبة. للاناث، ن = 29 لـ PCC1 و ن = 27 للمركبة. ل ج-حويو ن = 3 فحوصات مستقلة بيولوجياً. يتم عرض البيانات كمخططات مربع وشعر ، حيث يمتد المربع من 25 إلى 75 بالمائة مع عرض الوسيط كخط في المنتصف ، وتشير الشعيرات إلى القيم الأصغر والأكبر (د-حون) أو يعني ± sd (ال). ثنائي الذيل غير زوجي ر-الاختبارات (ج-يونوال) ونماذج انحدار المخاطر النسبية من كوكس (إلوم) لتحديد الدلالة الإحصائية. لإثبات إمكانات القضاء على الخلايا الشائخة لإطالة العمر المتبقي لفئران WT ، أجرينا علاج PCC1 بدءًا من سن متقدم جدًا (الشكل 1 ب). 8 كيلو). الفئران التي تتلقى إعطاء PCC1 (مرة كل أسبوعين أو كل أسبوعين) بدءًا من عمر 24 إلى 27 شهرًا (أي ما يعادل تقريبًا عمر 75-90 عامًا في البشر) كان متوسط عمر ما بعد العلاج 64.2٪ (أو 9.4٪ أطول بشكل عام) مدى الحياة) وانخفاض خطر الوفيات (65.0٪ ، ص <0.0001) من المجموعة المعالجة بالمركبة (الشكل. 8 لتر ، م). تشير هذه البيانات إلى أن PCC1 يمكن أن يقلل بشكل كبير من خطر الوفيات المرتبطة بالعمر في الفئران المسنة. تساءلنا بعد ذلك عما إذا كان معدل الوفيات المنخفض في الحيوانات المسنة قد أدى إلى زيادة معدلات الاعتلال في أواخر العمر. قمنا بقياس الوظيفة الجسدية في الفئران التجريبية التي عولجت بـ PCC1 أو السيارة شهريًا حتى الموت. على الرغم من العمر المتبقي الأطول للفئران المعالجة بـ PCC1 ، فإن الوظيفة البدنية في الشهرين الأخيرين من الحياة لم تكن أقل بكثير من تلك الموجودة في الفئران المعالجة بالمركبة (الشكل 5 ب). 8n). عند تشريح الجثة ، لم يكن معدل حدوث العديد من الأمراض المرتبطة بالعمر وعبء الورم وسبب الوفاة مختلفًا بشكل كبير بين الفئران المعالجة بـ PCC1 والمعالجة بالمركبة (الشكل 1 ب). 8o والبيانات الموسعة الشكل. 9 أ ، ب). ومع ذلك ، تم تقليل التعبير عن SASP في الأعضاء الصلبة ، والذي كان متوافقًا إلى حد كبير مع انخفاض المستويات المتداولة للإنترلوكين (IL) -6 ، وعامل تحفيز المستعمرات (CSF) 2 وبروتين الجذب الكيميائي أحادي الخلية (MCP) 1 ، علامات SASP التمثيلية في الدم المحيطي (البيانات الموسعة الشكل. 9 ج - ص). لاحظنا أيضًا انخفاض التعبير عن SASP في CD3+ الخلايا التائية في الدم المحيطي (البيانات الموسعة الشكل. 9 جرام) ، سلالة الخلية التي تُظهر زيادة قوية في p16INK4a التعبير أثناء شيخوخة الإنسان54. علاوة على ذلك ، قلل علاج PCC1 من الإجهاد التأكسدي في أنسجة الكبد ، كما يتضح من انخفاض في مقاربات منتج بيروكسيد الدهون 4-hydroxynonenal (HNE) وزيادة نسبة الجلوتاثيون المختزل إلى المؤكسد (البيانات الموسعة الشكل. 9 ح ، أنا) ، بما يتوافق مع الخصائص العامة لمركبات الفلافونويد ، التي تمارس نشاطًا مضادًا للأكسدة من خلال مقاومة الجذور الحرة وإشراك نظام الدفاع المضاد للأكسدة55و56. باختصار ، يمكن لعامل الحالة للشيخوخة PCC1 ، وهو مكون كيميائي نباتي مشتق من GSE (أو بدلاً من ذلك ، بوفرة أقل ، من المنتجات الطبيعية مثل مستخلصات القرفة والكاكاو وقشور التفاح ولحاء الصنوبر) ، أن يقلل من عبء الشيخوخة وربما الخلايا الأخرى تطوير نمط ظاهري مؤيد للالتهابات ويعتمد بطبيعته على المسارات المضادة للاستماتة المرتبطة بالشيخوخة المؤيدة للبقاء وزيادة عمر ما بعد العلاج دون التسبب في ارتفاع معدلات المراضة في الفئران. نقدم بموجب هذا الدليل إثباتًا للمبدأ على أنه حتى عند إعطائه في أواخر العمر ، فإن مثل هذه الطريقة العلاجية تحمل إمكانات بارزة لتأخير الخلل الوظيفي المرتبط بالعمر بشكل ملحوظ ، وتقليل الأمراض المرتبطة بالعمر وتحسين الظروف الصحية ، وبالتالي توفير وسيلة جديدة لتحسين هيلثسبان وعمرها في طب الشيخوخة في المستقبل. الشيخوخة هي في الأساس عملية حتمية تؤدي تدريجياً إلى تدهور وظيفي في جميع الكائنات الحية تقريبًا. ظهر شيخوخة الخلايا ، وهي حالة من توقف النمو الدائم ، مؤخرًا كعلامة مميزة ومحرك للشيخوخة3و57. تتراكم الخلايا الشائخة في الأنسجة المسنة بمرور الوقت وتساهم في زيادة قائمة الأمراض58. تطيل إزالة الخلايا الشائخة من الفئران ذات العمر الطبيعي أو الفئران التي تتقدم في العمر بشكل طبيعي الفترة الصحية ، وتزيد من العمر وتقييد الاضطرابات المرتبطة بالعمر بما في ذلك على سبيل المثال لا الحصر تصلب الشرايين والتهاب المفاصل والأمراض التنكسية العصبية59و60و61و62. دفعت التطورات الحديثة في الدراسات المتعلقة بالعمر إلى البحث عن الأدوية التي يمكن أن تستهدف الخلايا المتشيخة بشكل انتقائي ، لا سيما فئة جديدة من العوامل الواقية للشيخوخة والتي يطلق عليها أدوية الحالة للشيخوخة أو ، بشكل أقل عدوانية ، المسخ. حتى الآن ، تم الإبلاغ عن عدد قليل من الأدوية الحالة للشيخوخة ، بما في ذلك dasatinib و quercetin و fisetin و piperlongumine ومثبطات بروتين الصدمة الحرارية (HSP) 90 ومثبطات عائلة BCL-2 مثل ABT-263 (navitoclax) و ABT-737 (المراجع. 11و12و13و18و19و21و22). من بينها ، مثبطات BCL-2 هي الأكثر استخدامًا للشيخوخة ، على الرغم من أنها تم تطويرها في الأصل كعلاجات للورم الليمفاوي. يستهدف ABT-737 BCL-2 و BCL-xL و BCL-w ولكن مع قابلية ذوبان منخفضة وتوافر حيوي عن طريق الفم. أكثر فاعلية للاستخدام في الجسم الحي ، يثبط ABT-263 بشكل رئيسي BCL-2 و BCL-xL ، في حين أنه غالبًا ما يسبب نقص الصفيحات. بالنظر إلى الآثار الجانبية الملحوظة لبعض المركبات الحالة للشيخوخة ، هناك حاجة لتحديد المركبات الجديدة ذات النشاط التحلل للشيخوخة ولكنها منخفضة السمية الخلوية. في هذه الدراسة ، قمنا بفحص مكتبة الأدوية القائمة على PDMA والتي تتكون أساسًا من المنتجات الطبيعية بهدف تحديد عامل (عوامل) جديدة يمكنها استهداف الخلايا المتشيخة على نطاق واسع مع الفعالية والسلامة المثلى في الجسم الحي. نتيجة لذلك ، حددنا PCC1 ، وهو عامل كيميائي نباتي مشتق من مصادر طبيعية ، كمركب واسع الطيف للشيخوخة. كميزة خاصة ، يمكن أن يعمل PCC1 بدلاً من ذلك كعامل مشوه لتقليل تعبير SASP عند استخدامه بتركيزات منخفضة. تشبه هذه الميزة المفيدة لـ PCC1 إلى حد كبير تلك الخاصة بـ GSE ، والتي يمكن أن تولد تأثيرات مشوهة ومزيل للشيخوخة. أظهرت الاستراتيجيات الجينية والدوائية مجموعة من الفوائد للتخلص من الخلايا الشائخة لتأخير الشيخوخة والسيطرة على الأمراض. يمكن أن يحدث الشيخوخة الخلوية عن طريق مجموعة متنوعة من المحفزات التي تتراوح من التنشيط الورمي ، والإجهاد السام الجيني ، إلى الاستجابة الالتهابية والإرهاق التكراري. يتم تحديد العديد من المركبات على أنها محللات للشيخوخة واسعة الطيف ، في حين أن البعض الآخر انتقائي ضد نوع معين فقط من الخلايا الشائخة. تشير الاختلافات في الخصوصية إلى اختيارات فردية لمضادات الشيخوخة ، والتي تعتمد بشكل أساسي على الاستخدام السريري المقصود. كشفت دراسة حديثة أن ouabain ، وهو مركب طبيعي ينتمي إلى عائلة جليكوسيد القلب ، كعامل مضاد للشيخوخة يمكن استخدامه لكل من القضاء على الخلايا الشائخة وعلاج السرطان ، ويتم تنفيذ هذا الأخير من خلال آلية عمل مزدوجة63. في هذا العمل ، اكتشفنا PCC1 باعتباره مادة أخرى جديدة وطبيعية وقوية للشيخوخة ، والتي تحفز بشكل انتقائي وعلى وجه التحديد موت الخلايا المبرمج للخلايا الشائخة ولكن مع سمية خلوية محدودة للخلايا المتكاثرة64. من الجدير بالملاحظة أنه عند التركيزات المنخفضة ، يمنع PCC1 تعبير SASP ، وهي خاصية مشتركة بين بعض مركبات الفلافونويد المشتقة من النبات مثل apigenin و kaempferol ، والتي يمكن أن تعمل كشيخوخة للحد من تأثير الخلايا الشائخة على الظروف المرتبطة بالعمر65و66. على الرغم من أن القليل من الدراسات قد كشفت عن مثل هذه الآلية المزدوجة للعوامل الطبيعية في استهداف الخلايا الشائخة ، فإن سطح كيرسيتين المركب مؤخرًا يعمل على وظيفة Fe3ال4 عرضت الجسيمات النانوية كلاً من إمكانات الحالة للشيخوخة والشيخوخة في الخلايا الليفية البشرية من خلال تعزيز نشاط بروتين كيناز المنشط AMP (AMPK)67. تبدو الآلية التي يحقق بها PCC1 تأثيرات الحالة للشيخوخة معقدة وتتطلب مزيدًا من الدراسة. تشير بياناتنا إلى أن PCC1 يضعف السلامة الوظيفية للميتوكوندريا ، مما يضر بالميكرومتر ، مما يؤدي إلى زيادة إنتاج الجذور الحرة مثل ROS ويسبب إطلاق السيتوكروم ج في الخلايا الشائخة ولكن ليس في الخلايا المتكاثرة. أحد الأسباب المحتملة لهذه الخصوصية هو أن الخلايا الشائخة تميل إلى تطوير غشاء بلازمي غير مستقطب ولديها تركيزات متزايدة من H+ (المرجع. 64) ، وهي ميزة قد تجعلهم أكثر عرضة لعمل PCC1. وتجدر الإشارة إلى أن هذه التعديلات مصحوبة بتعبير منظم عن العوامل المؤيدة لموت الخلايا المبرمج ، وتحديداً NOXA و PUMA ، الأحداث التي تعزز أيضًا موت الخلايا المبرمج للشيخوخة بشكل حاسم. ضمن عائلة البروسيانيدين ، من المعروف أن أعضائها مشتق من بلمرة جزيئات الفلافان-3-أول وتوجد كأوليغومرات أو بوليمرات28، يبدو أن PCC1 فريد وظيفيًا. تشير بياناتنا التجريبية إلى وجود اختلاف ملحوظ بين PCC1 (أداة تقليم) والبروسيانيدينات الأخرى (معظمها عبارة عن مونومرات أو ثنائيات ، مثل PCB2). نظرًا لأننا لم نفحص بشكل شامل أفراد عائلة البروسياندين ، فإن ما إذا كان عدد المونومرات في الجزيء يحدد إمكاناته المضادة للشيخوخة يظل سؤالًا مفتوحًا ولكنه مثير للاهتمام ، والآليات الأساسية تستحق دراسات مستمرة في المستقبل. الشيخوخة الخلوية في حد ذاتها هي عملية غير متجانسة للغاية تعتمد على أصول الخلايا المختلفة والمحفزات البيئية68. تتمثل إحدى السمات الرئيسية لـ PCC1 في قدرته على إزالة الخلايا الشائخة بكفاءة في مجموعة واسعة من أنواع الخلايا والضغوطات ، بما في ذلك التكاثر والجينات المسرطنة والإشعاع والعلاج الكيميائي. في هذه الدراسة ، قارنا PCC1 مع أدوية أخرى للشيخوخة تم الإبلاغ عنها للتأثيرات على الخلايا اللحمية البشرية ، والخلايا الليفية ، و HUVECs و MSCs ، وأنواع الخلايا الرئيسية في البيئة الدقيقة للأنسجة. كما ورد ، ABT-263 يقضي على الخلايا الليفية الجنينية البشرية (HEFs) و HUVECs ولكن له تأثير ضئيل على الخلايا الشحمية البشرية12و18. يمكن أن يؤدي الاستخدام المشترك لـ dasatinib و quercetin إلى استنفاد جميع الأنواع الثلاثة من الخلايا الشائخة بطريقة تعتمد على الجرعة ولكنها سامة للخلايا المتكاثرة11و69و70. يُظهر Fisetin ، وهو فلافونويد طبيعي آخر تم الإبلاغ عنه كعامل حال للشيخوخة ، تأثيرات متواضعة على HEFs الشيخوخة والخلايا الدهنية السابقة فقط بتركيزات عالية20و21. على النقيض من ذلك ، فإن PCC1 لديه القدرة على التغلب على هذه القيود ، بما في ذلك الاعتماد على نوع الخلية ، والسمية العالية في الخلايا غير السائلة ، والكفاءة المنخفضة ضد الخلايا المتشيخة. على الرغم من أنه ، عند استخدامه بمفرده ، أظهر الكيرسيتين (فلافونويد آخر في GSE) في حد ذاته سمية خلوية ضد الخلايا اللحمية الشائخة ، إلا أن فعاليته أقل عمومًا من فعالية PCC1 (قارن الشكل. 2 أ ، ج والتين التكميلي. 3n و 4 ن). معًا ، يتمتع PCC1 بنشاط حال للشيخوخة فائق مع خصوصية وكفاءة عالية لمجموعة واسعة من أنواع الخلايا أكثر من العديد من الأدوية الحالة للشيخوخة التي تم الإبلاغ عنها مثل ABT-263 و dasatinib و quercetin و fisetin ويمكن أن تستهدف الخلايا الشائخة الناتجة عن عدة أنواع رئيسية من محرضات الشيخوخة. وجدنا أن PCC1 يمارس تأثيرًا محفزًا على موت الخلايا المبرمج على الخلايا الشائخة في ظل ظروف الجسم الحي. يقضي PCC1 على الخلايا المتشيخة الناتجة عن العلاج بشكل فعال ويقلل من علامات الشيخوخة في الأعضاء الصلبة ، مما يبرز فعاليته في الجسم الحي. في هذه الدراسة ، عالجنا أيضًا الفئران ذات العمر الطبيعي باستخدام PCC1 واختبرنا تأثيره على الخلايا الشائخة والالتهابات المزمنة والوظيفة الجسدية. أولاً ، استنفد علاج PCC1 الخلايا المتشيخة في أنسجة متعددة وقلل من التواقيع المرتبطة بـ SASP كما هو موضح في تحليل GSEA. ثانيًا ، يمكن أن يمنع PCC1 التعبير عن الجينات المرتبطة بـ SASP في الكبد والكلى المسنين ويقلل الالتهاب المزمن منخفض الدرجة في الدم. ثالثًا ، يخفف PCC1 من ضعف الوظيفة الحركية والتوازن والتمارين المرهقة وقوة العضلات والاستكشاف التلقائي في الفئران المسنة. الاكثر اهمية، تم تحسين الأداء في اختبار RotaRod واختبار توازن الحزمة في المجموعة المعالجة بـ PCC1 مقارنةً بذلك في حالة المعالجة الأولية. بشكل جماعي ، يستهدف المركب الكيميائي النباتي PCC1 بشكل انتقائي الخلايا الشائخة في البيئة الدقيقة للأنسجة ويولد تأثيرات بيولوجية ملحوظة في الفئران التي تتقدم في السن بشكل طبيعي. على غرار النظراء المركب كيميائيًا ، بروسيانيدينس المشتق بشكل طبيعي يظهر أنشطة مضادة للالتهابات ومضادة لالتهاب المفاصل ومضادة للحساسية ومضادة للسرطان وتنظيف الجذور الحرة للأكسجين وقمع نشاط بيروكسيد الناجم عن الإشعاع36و71. نظرًا لكونه عنصر تقليم إيبيكاتشين معزول عن المواد النباتية ، وبشكل بارز من بذور العنب ، فقد ثبت أن PCC1 يوفر فوائد صحية في الحالات المرضية المزمنة72. ومع ذلك ، فإن التقييم الشامل للتأثيرات السمية لـ PCC1 في الجسم الحي أمر بالغ الأهمية للتطبيق السريري المحتمل. أظهرت بياناتنا أن المعالجة عالية التركيز (20 مجم لكل كيلوغرام) وعالية التردد PCC1 (كل أسبوعين) لا تحتوي على سمية جهازية واضحة. باختصار ، توضح دراستنا التفوق والأمان النسبي لاستراتيجية الحماية من الشيخوخة التي تستهدف بشكل انتقائي الخلايا الشائخة في الأنسجة المسنة أو المتضررة من العلاج عبر مجموعة واسعة من أنواع الخلايا. ومع ذلك ، من الممكن أن تختلف تركيزات PCC1 في الجسم الحي باختلاف الأعضاء وتعتمد على الجرعة المعطاة وديناميكيات الدواء والحركية الدوائية وأن التركيزات المحلية ليست عالية بما يكفي لتحقيق تأثير مضاد للشيخوخة في بعض أنواع الأنسجة. في هذه الحالة، إجمالاً ، تفتح دراستنا طريقًا جديدًا لإطالة فترة الصحة وإطالة العمر الافتراضي وعلاج الأمراض المرتبطة بالعمر بعامل علاجي للشيخوخة (مع كل من إمكانات الشيخوخة والشيخوخة) ، المستمدة من مصادر طبيعية وتمتلك فعالية واضحة. توفر التأثيرات المحتملة لمكافحة الشيخوخة لـ PCC1 الموضحة في فحوصاتنا قبل السريرية دعمًا جيدًا لمزيد من التطوير التحولي والسريري لـ PCC1 ، مع الهدف العام المتمثل في تحقيق حياة أطول وأكثر صحة.الأساسية
نتائج
تركيزات منخفضة من GSE تقيد التعبير SASP
GSE له نشاط مضاد للشيخوخة بتركيزات عالية
يحتوي مكون PCC1 في GSE على نشاط مضاد للشيخوخة
يتسبب PCC1 في حدوث خلل وظيفي في الميتوكوندريا في الخلايا الشائخة
يعزز PCC1 انحدار الورم ويقلل من المقاومة الكيميائية

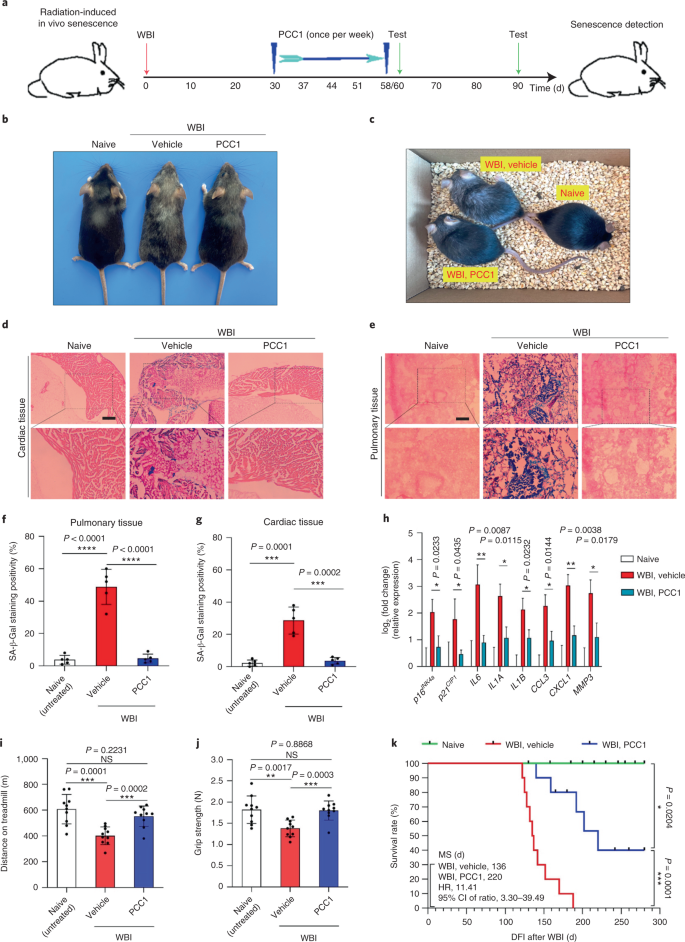
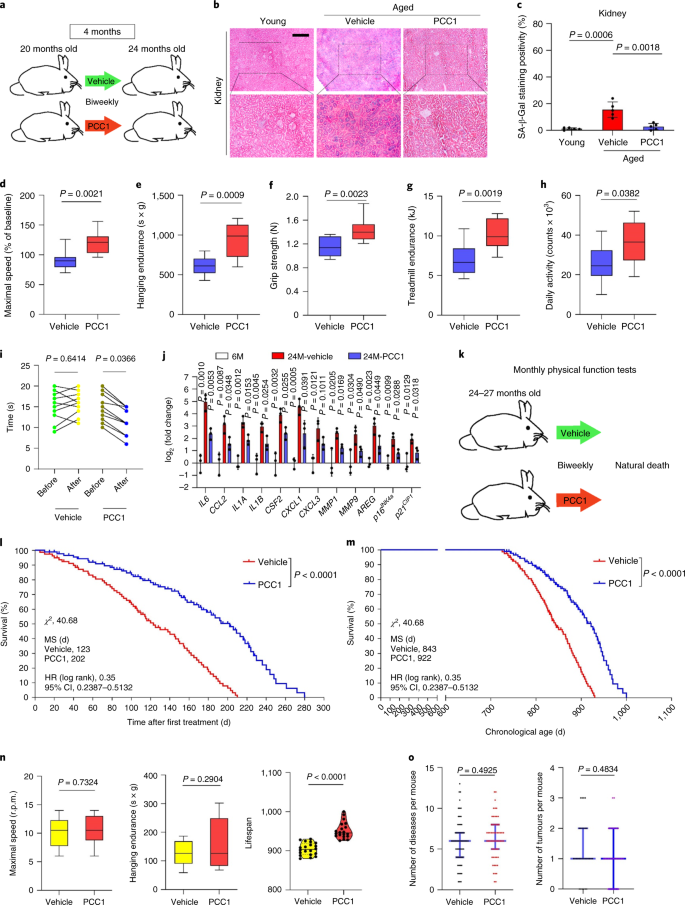
تخفف إزالة الخلايا الشائخة نتيجة علاج PCC1 من الخلل الوظيفي الجسدي
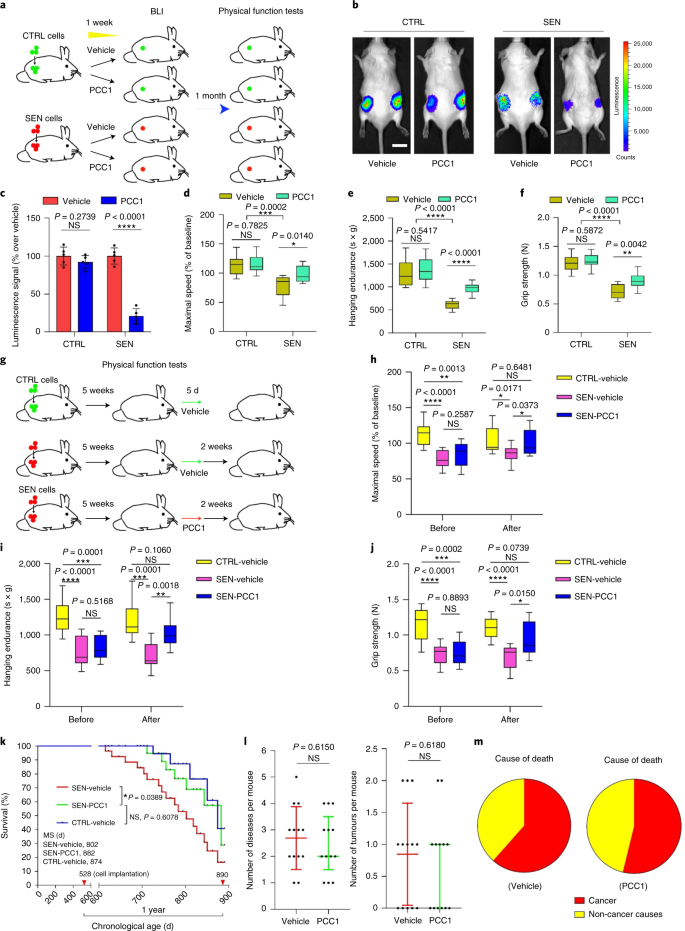
يحافظ PCC1 على الوظيفة البدنية ويطيل من بقاء الفئران المسنة
مناقشة




